
| A. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 | |
| B. | 电解熔融氯化钠时,钠离子被还原为钠 | |
| C. | 钠是一种灰黑色的固体 | |
| D. | 钠的质地软,熔点低于100℃ |
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题
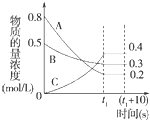 在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题:
在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题: 2C.
2C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(A)>r(B)>r(D)>r(C) | B. | 离子半径:r(C3-)>r(D-)>r(B+)>r(A2+) | ||
| C. | 原子序数:d>c>b>a | D. | 单质的还原性:A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该硫铁矿含FeS2也是48% | B. | 硫损失也是2% | ||
| C. | 铁损失也是2% | D. | 该硫铁矿含铁42% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和④ | B. | ②和③ | C. | ①和③ | D. | ②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
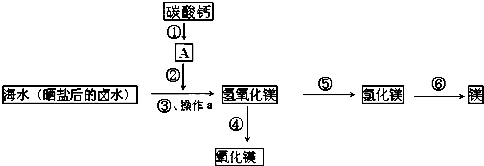
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中N-C-N键角为90° | |
| B. | C(N3)4中碳元素为正价,C(N3)4分子中存在极性键和非极性键 | |
| C. | C(N3)4就是石墨吸附N2后所得的物质 | |
| D. | 该物质为分子晶体,每18g C(N3)4完全分解可产生13.44L的气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com