
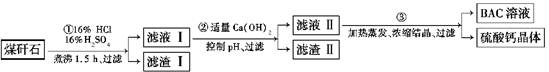
 Al(OH)3(aq)+3HCl(aq)ΔH=+200a kJ·mol-1
Al(OH)3(aq)+3HCl(aq)ΔH=+200a kJ·mol-1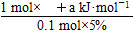 =+200a kJ·smol-1,其热化学方程式为AlCl3(aq)+3H2O(l)
=+200a kJ·smol-1,其热化学方程式为AlCl3(aq)+3H2O(l) Al(OH)3(aq)+3HCl(aq) ΔH=+200a kJ·mol-1。
Al(OH)3(aq)+3HCl(aq) ΔH=+200a kJ·mol-1。

科目:高中化学 来源:不详 题型:单选题
| 选项 | 内容 | 评价 |
| A | 一定条件下0.5mol N2和1.5molH2反应,平衡时放热akJ,则N2(g)+3H2(g)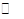 2NH3(g) 2NH3(g) 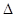 H=2akJ·mol-1 H=2akJ·mol-1 | 正确 |
| B | 氯化镁溶液与氨水反应: Mg2++2OH-=Mg(OH)2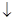 | 错误,氨水不应写成离子形式 |
| C | 向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO42-=BaSO4 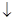 | 正确 |
| D | 等物质的量的Cl2与FeBr2在溶液中反应: 2Fe2++2Br-+2C12==2Fe3++4Cl-+Br2 | 错误,Fe2+与Br-的化学计量数之比应为l:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.⑤ | C.②⑤ | D.④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| B.明矾溶液中滴加Ba(OH)2溶液至SO42–恰好完全沉淀:Al3++Ba2++ SO42–+3OH–=BaSO4↓+Al(OH)3↓ |
| C.200 mL 2 mol·L–1的FeBr2溶液中通入11.2 L标准状况下的氯气:4 Fe2++6Br–+5Cl2=4Fe3++3Br2+ 10Cl– |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO–+2Fe(OH)3=2FeO42–+3Cl–+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.硫化钠的水解反应:S2—+2H2O H2S+2OH- H2S+2OH- |
B.硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2 2Fe3++2H2O 2Fe3++2H2O |
C.碳酸氢钙溶液中加入足量烧碱溶液:HCO32—+OH- CO32—+H2O CO32—+H2O |
D.玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH- Na2SiO3↓+H2O Na2SiO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 KI3
KI3| A.Na2S2O3 | B.AlCl3 | C.Na2CO3 | D.NaNO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaAlO2溶液中通入过量CO2:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32- |
| B.往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O |
| C.氧化铜溶于浓硝酸:CuO+2H+=Cu2++2H2O |
| D.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+ Fe3++3H2O Fe3++3H2O |
B.小苏打溶液呈碱性的原因:HC +H2O +H2O H3O++C H3O++C |
C.稀硝酸中加入足量的铁屑:3Fe+8H++2N  3Fe2++2NO↑+4H2O 3Fe2++2NO↑+4H2O |
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液:N +Al3++2S +Al3++2S +2Ba2++5OH- +2Ba2++5OH- Al Al +2BaSO4↓+NH3·H2O+2H2O +2BaSO4↓+NH3·H2O+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu(OH)2中加入硫酸:OH- + H+ = H2O |
| B.Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3+ + 3SO42-+ 3Ba2+ + 6OH-= 2Al(OH)3↓ + 3BaSO4↓ |
| C.钠加入水中:Na+ 2H2O= Na+ + 2OH- + H2↑ |
D.向浓盐酸中加二氧化锰:MnO2+ 4H+ + 2Cl- Mn2+ + 2H2O + Cl2↑ Mn2+ + 2H2O + Cl2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com