
【题目】当反应 COCl2(g)![]() CO(g)+Cl2(g) ΔH>0达到平衡时,分别只再采取下列措施:①升温;②恒容通入惰性气体;③增加CO浓度;④减压;⑤加催化剂;⑥恒压通入惰性气体。其中,能提高COCl2转化率的措施是( )
CO(g)+Cl2(g) ΔH>0达到平衡时,分别只再采取下列措施:①升温;②恒容通入惰性气体;③增加CO浓度;④减压;⑤加催化剂;⑥恒压通入惰性气体。其中,能提高COCl2转化率的措施是( )
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
科目:高中化学 来源: 题型:
【题目】实验室按如下装置测定纯碱(含少量 NaCl)的纯度。下列说法错误的是
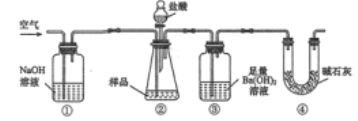
A. 实验前, 应进行气密性检查
B. 必须在装置②、 ③间添加吸收 HCl 气体的装置
C. 装置④的作用是防止空气中的 CO2进入装置③与 Ba(OH)2 溶液反应
D. 反应结束时,应再通入空气将装置②中产生的气体完全转移到装置③中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种重要金属:
(1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为: ___________ 。
(2)铝还用于冶炼熔点较高的金属如钒、铬、锰等,请配平下列用铝冶炼金属钒的化学反应方程式: V2O5 + Al ==== Al2O3 + V_____________
该反应中氧化剂是_____________ ,要得到1mol金属钒,需要纯铝的质量__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、 B、 C、 D、 E、 F 为前四周期元素且原子序数依次增大,其中基态 A 原子的电子分布在 3 个能级,且每个能级所含的电子数相同; C 的原子核外最外层有 6 个运动状态不同的电子; D 是短周期元素中电负性最小的元素; E 的最高价氧化物的水化物酸性最强; 基态 F 原子核外最外层只有一个电子, 其余能层均充满电子。 G 元素与 D 元素同主族,且相差 3 个周期。
(1)元素 A、 B、 C 的第一电离能由小到大的是____________________(用元素符号表示)。
(2)E的最高价含氧酸中 E 原子的杂化方式为_____________。 基态 E 原子中,核外电子占据最高能级的电子云轮廓形状为____________________________。
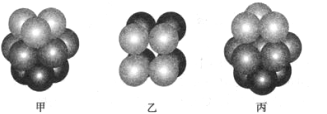
(3)F原子的外围电子排布式为_______________________, F 单质晶体中原子的堆积方式是下图中的_______(填写“甲”、 “乙”或“丙”) ,该晶体的空间利用率为_____________。(保留两位有效数字)
(4)已知元素 A、B形成的(AB)2分子中所有原子都满足 8电子稳定结构,则其分子中 σ键与 π键数目之比为__________。
(5)通常情况下, D 单质的熔沸点比 G 单质高,原因是_________________________。
(6)已知 DE 晶体的晶胞如下图所示:
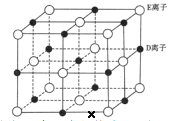
若将 DE 晶胞中的所有 E 离子去掉,并将 D 离子全部换为 A 原子,再在其中的 4 个“小立方体”中心各放置一个A 原子,且这 4 个“小立方体”不相邻。位于“小立方体”中的 A 原子与最近的 4 个 A 原子以单键相连,由此表示 A的一种晶体的晶胞(已知 A—A 键的键长为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_________个 A 原子,该晶体的密度是______________g·cm-3(列式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图所示装置探究氯气能否与水发生反应。已知气体a的主要成分是含有少量水蒸气的氯气。请回答下列问题:
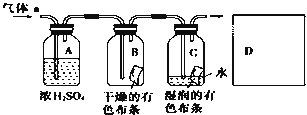
(1)浓硫酸的作用是_____________________________________。
(2)写出实验室制取Cl2的化学方程式_______________________________。
(3)证明氯气和水发生反应的实验现象为___________________________。
(4)该实验设计存在的缺陷是________,为了克服该缺陷,需要补充装置D,其中发生反应的离子方程式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C都是金属,把A浸入C的硫酸盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极。A、B、C三种金属的活动性顺序为
A.A>B>CB.A>C>BC.B>A>CD.B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质用途的叙述中,不正确的是( )
A.氨可用作制冷剂
B.可用铝制容器盛装浓盐酸
C.硅是太阳能电池的常用材料
D.铁红常用于制红色油漆和涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示为常见玻璃仪器的部分结构:
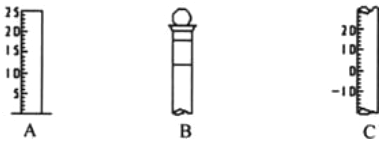
(1)请写出所列仪器的名称: A______,B_______,C_______;
(2)仪器 B 使用前必须__________________。
(3)仪器 B 上标记有________(填序号);①质量 ②温度 ③刻度线 ④浓度 ⑤容积
II.已知某“84 消毒液”瓶体部分标签如图所示,该“84 消毒液”通常稀释 100 倍(体积之比)后使用。请回答下列问题:
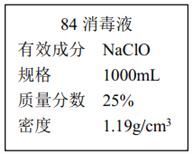
(1)该“84 消毒液”的物质的量浓度约为___mol·L-1。保留两位有效数字)
(2)某同学取100 mL该液”,稀释后用于消毒,稀释后的溶液中 c (Na+)=_____ mol·L-1。
(3)该同学参阅该“84 消毒液”的配方,欲用 NaClO 固体配制 250 mL含 NaClO 质量分数为 25%的消毒液。下列说法不正确的是________(填序号)。
a.如图所示的仪器中,有三种是不需要的,还需要其它玻璃仪器
b.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
c.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
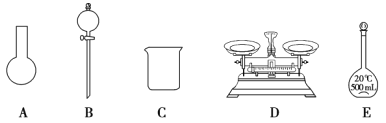
(4) “84 消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用 98%(密度为1.84g·cm-3)的浓硫酸配制2 000 mL 2.3 mol·L-1 的稀硫酸用于增强“84 消毒液”的消毒能力。需用浓硫酸的体积为___mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com