
分析 根据c=$\frac{1000ρw}{M}$计算浓盐酸的物质量浓度;根据c(浓)×V(浓)=c(稀)×V(稀)计算取用的浓盐酸的体积.
解答 解:c=$\frac{1000ρw}{M}$=$\frac{1000×36.5%×1.25}{36.5}$mol/L=12.5 mol/L;
溶液稀释前后溶质的物质的量不变,则有c(浓)×V(浓)=c(稀)×V(稀),又配置240mL 0.1mol/L的盐酸,应选择250mL的容量瓶,计算按照250mL计算,所以 V浓=$\frac{{{C_稀}•{V_稀}}}{C_浓}$=$\frac{0.25×0.1}{12.5}$L=0.002L=2ml;
答:此浓盐酸的物质的量浓度是12.5mol/L;则需要取用的浓盐酸的体积2mL.
点评 本题考查物质的量浓度的计算,题目难度不大,注意质量分数与物质的量浓度之间的换算关系.


科目:高中化学 来源: 题型:解答题
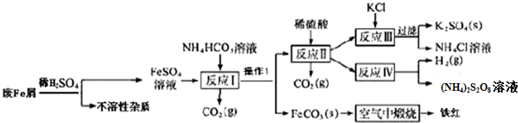
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑦ | B. | ①②③⑤⑥⑦ | C. | ①②③④ | D. | ②③⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在江河入海处易形成三角洲 | |
| B. | AgNO3溶液中滴入同浓度NaCl溶液,生成白色沉淀 | |
| C. | 卤水点豆腐 | |
| D. | 同一钢笔同时使用不同牌号的墨水易发生堵塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
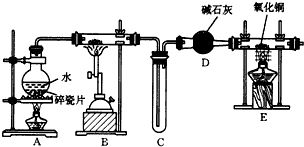
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
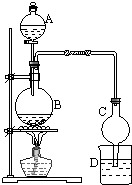 (1)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有乙醇、乙酸,D中盛有饱和碳酸钠溶液.
(1)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有乙醇、乙酸,D中盛有饱和碳酸钠溶液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
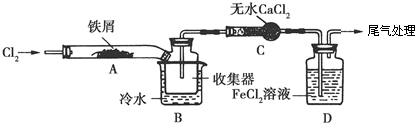
 .FeCl3是共价化合物(填“离子”或“共价”).
.FeCl3是共价化合物(填“离子”或“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com