
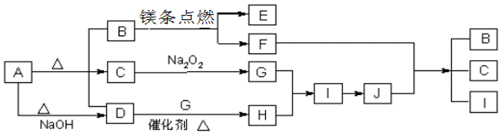
 .
.分析 A受热能分解,分解得到等物质的量的B、C、D,且A与碱反应生成气体D,B、D为常温下气态化合物,C为常温下液态化合物,C为水,则A为NH4HCO3,B能与镁反应,则B为CO2,E为MgO,F为C,结合D为NH3,水与过氧化钠反应生成G,G为O2,D与G反应生成H,H为NO,I为NO2,J为HNO3,再结合F与J反应生成B、C、I,符合上述转化,然后结合物质的性质及题目要求来解答.
解答 解:A受热能分解,分解得到等物质的量的B、C、D,且A与碱反应生成气体D,B、D为常温下气态化合物,C为常温下液态化合物,C为水,则A为NH4HCO3,B能与镁反应,则B为CO2,E为MgO,F为C,结合D为NH3,水与过氧化钠反应生成G,G为O2,D与G反应生成H,H为NO,I为NO2,J为HNO3,再结合F与J反应生成B、C、I,符合上述转化,
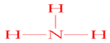
(1)由上述分析可知A为NH4HCO3,D为NH3,氨气分子中含有3个N-H键,其结构式为: ,
,
故答案为:NH4HCO3; ;
;
(2)F+J→B+C+I的反应为为碳与浓硝酸生成二氧化碳、二氧化氮和水,反应方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(3)由4NO2+O2+2H2O═4HNO3,倒立于盛水的水槽中,水全部充满试管,则原混合气体中NO2占$\frac{4}{5}$,其体积为:10mL×$\frac{4}{5}$=8mL,生成硝酸的物质的量等于二氧化氮物质的量,n(NO2 )=$\frac{8×1{0}^{-3}L}{22.4L/mol}$=$\frac{1}{2.8}$×10-3mol,则反应后硝酸的物质的量为:n(HNO3)=n(NO2 )=$\frac{1}{2.8}$×10-3mol,
所得溶液浓度为:c(HNO3)=$\frac{\frac{1}{2.8}×1{0}^{-3}L}{10×1{0}^{-3}L}$≈0.036mol•L-1,
故答案为:8mL;0.036 mol/L.
点评 本题考查无机物的推断,题目难度中等,利用物质的转化推断出各物质是解答本题的关键,C及A为解答本题的突破口,试题培养了学生的分析能力及逻辑推理能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
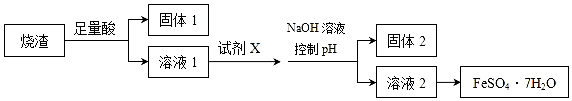
| A. | 溶液1中的阳离子可与NH4+、HCO3-、I-、SO42-在同一溶液中大量共存 | |
| B. | 向溶液2中加入3-5滴K3[Fe(CN)6](铁氰化钾)溶液,可观察到有蓝色沉淀生成 | |
| C. | 向固体2中加入足量NaOH溶液,发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O | |
| D. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除零族元素外,短周期元素的最高化合价在数值上等于该元素所属的族序数 | |
| B. | ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数 | |
| C. | 除短周期外,其他周期均有18种元素 | |
| D. | X2+的核外电子数目为18,则X在第三周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 →
→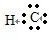
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
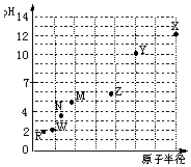 同一短周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )
同一短周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )| A. | 气态氢化物的稳定性:M>N | |
| B. | Z的最高价氧化物能溶于稀氨水 | |
| C. | X和W形成的常见化合物中阴、阳离子个数比为2:1 | |
| D. | Z和R的简单离子半径:Z3+<R- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com