
为了预防碘缺乏病,有关部门规定食盐中的碘含量(以I计)应在20~50 mg/Kg。制备KIO3的方法如下:
方法1:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;KH(IO3)2+KOH=2KIO3+H2O
方法2:碱性条件下,
方法3:
⑴与方法3相比方法1的不足是 ,方法2的不足是 。
⑵方法2选用的电极是惰性电极,则其阳极反应式是 。
⑶方法3反应温度控制在70℃左右,不采用更高温度的主要原因是 。
⑷制备纯净KIO3的实验步骤中,最后需将所得晶体最好使用 洗涤2~3次,干燥后得产品。
⑸已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-。为测定加碘食盐中碘的含量,设计的方案如下。请完善实验步骤并计算测定结果:
a.准确称取w g食盐于锥形瓶中,再加适量蒸馏水使其完全溶解。
b. 。
c.向锥形瓶中滴加2.0×10-3 mol/L Na2S2O3标准溶液至终点。
d.重复上述实验两次。
三次实验的数据记录如下表。则所测加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
|
滴定次数 |
盛标准Na2S2O3溶液的读数 |
|
|
滴定前刻度(/mL) |
滴定后刻度(/mL) |
|
|
1 |
1.02 |
11.03 |
|
2 |
2.00 |
11.99 |
|
3 |
0.20 |
10.20 |
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| H2O2,H+ |
| 70℃ |
| K2CO3 |
| 滴定次数 | 盛标准Na2S2O4溶液的读数 | |
| 滴定前刻度(/mL) | 滴定后刻度(/mL) | |
| 1 | 1.02 | 11.03 |
| 2 | 2.00 | 11.99 |
| 3 | 0.20 | 10.20 |
| 1270 |
| 3w |
| 1270 |
| 3w |
查看答案和解析>>
科目:高中化学 来源: 题型:022
现代生活中,人们越来越注意微量元素的摄入.碘元素对人体健康有着至关重要的作用.为了预防碘缺乏病,我国卫生部规定每千克食盐中应含有40-50mg碘酸钾.
回答下列问题:
(1)加碘食盐的包装袋上通常标有如下食用建议:勿长时间炖炒.请简述其中所包含的化学原理________.
(2)![]() 可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流强度下电解KI溶液.总反应方程式为:_____________________________________
可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流强度下电解KI溶液.总反应方程式为:_____________________________________
![]() ,则两极的电极反应式分别为:阴极________;阳极________.
,则两极的电极反应式分别为:阴极________;阳极________.
(3)为检验某食盐中是否含有碘酸钾,某同学取食盐样品428g完全溶解于水中,然后加入盐酸酸化的淀粉碘化钾溶液,结果溶液呈蓝色,则反应的离子方程式为________.为进一步确定该样品是否为合格产品,该生又用0.030 mol/L的硫代硫酸钠溶液滴定,当用去18.00mL时蓝色刚好褪去(反应方程式为:![]() ),由此通过计算可判断该加碘食盐为________(填“合格”或“不合格”)产品.
),由此通过计算可判断该加碘食盐为________(填“合格”或“不合格”)产品.
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
回答下列问题:
(1)加碘食盐的包装袋上通常标有如下食用建议:勿长时间炖炒.请简述其中所包含的化学原理________.
(2)![]() 可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流强度下电解KI溶液.总反应方程式为:_____________________________________
可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流强度下电解KI溶液.总反应方程式为:_____________________________________
![]() ,则两极的电极反应式分别为:阴极________;阳极________.
,则两极的电极反应式分别为:阴极________;阳极________.
(3)为检验某食盐中是否含有碘酸钾,某同学取食盐样品428g完全溶解于水中,然后加入盐酸酸化的淀粉碘化钾溶液,结果溶液呈蓝色,则反应的离子方程式为________.为进一步确定该样品是否为合格产品,该生又用0.030 mol/L的硫代硫酸钠溶液滴定,当用去18.00mL时蓝色刚好褪去(反应方程式为:![]() ),由此通过计算可判断该加碘食盐为________(填“合格”或“不合格”)产品.
),由此通过计算可判断该加碘食盐为________(填“合格”或“不合格”)产品.
查看答案和解析>>
科目:高中化学 来源:2004全国各省市高考模拟试题汇编·化学 题型:043
现代生活中,人们越来越注意微量元素的摄入.碘元素对人体健康有着至关重要的作用.为了预防碘缺乏病,我国卫生部规定每千克食盐中应含有40-50mg碘酸钾.
回答下列问题:
(1)加碘食盐的包装袋上通常标有如下食用建议:勿长时间炖炒.请简述其中所包含的化学原理________.
(2)KIO3可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流强度下电解KI溶液.总反应方程式为:
KI+3H2O KIO3+3H2↑,则两极的电极反应式分别为:阴极________;阳极________.
KIO3+3H2↑,则两极的电极反应式分别为:阴极________;阳极________.
(3)为检验某食盐中是否含有碘酸钾,某同学取食盐样品428g完全溶解于水中,然后加入盐酸酸化的淀粉碘化钾溶液,结果溶液呈蓝色,则反应的离子方程式为________.为进一步确证该样品是否为合格产品,该生又用0.030mol/L的硫代硫酸钠溶液滴定,当用去18.00mL时蓝色刚好褪去(反应方程式为:I2+2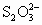 =2I-+
=2I-+ ),由此通过计算可判断该加碘食盐为________(填“合格”或“不合格”)产品.
),由此通过计算可判断该加碘食盐为________(填“合格”或“不合格”)产品.
查看答案和解析>>
科目:高中化学 来源: 题型:
(2)生活中,人们越来越注重微量元素的摄入,碘元素对人体健康与发育有着至关重要的作用。为了预防碘缺乏病,有关部门规定每千克食盐中应含有40—50 mg 的碘酸钾。已知碘酸钾可用电解方法制得,以石墨为阳极,不锈钢为阴极,在一定的电流强度和温度下电解KI溶液,总反应化学方程式为KI+3H2O![]() KIO3+3H2↑。阳极反应式是______________。
KIO3+3H2↑。阳极反应式是______________。
(3)火星探测车在火星大气中检测到了气体A。资料显示,A分子是三原子分子,其相对分子质量为60,在地球环境下A易分解。粉末状的KSCN与浓硫酸在一定条件下可得到气体A和两种硫酸氢盐,生成物的物质的量之比是1∶1∶1。则气体A的结构式是___________。
(4)随着人类对水的研究的不断深入,水的应用也越来越广泛。研究人员最近发现,在一定的实验条件下,给水施加一个弱电场,在
A.代替干冰 B.防止冰川熔化
C.在室温下制作冰雕 D.建室温溜冰场
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com