
| A. | y≥1.2 | |
| B. | 增大反应体系的压强,反应速率不一定增大 | |
| C. | v正(A)>v逆(C),不可能为平衡状态 | |
| D. | 混合气体的密度不再变化,一定为平衡状态 |
分析 A、速率之比等于对应物质的化学计量数之比,求B的反应速率;
B、加入稀有气体,体系压强增大,但反应体系中各组分的浓度不变;
C、平衡状态时v正(A)=3v逆(C),所以v正(A)>v逆(C),可能为平衡状态;
D、混合气体的密度一直不变.
解答 解:A、速率之比等于对应物质的化学计量数之比,B的反应速率为:0.3mol•L-1•min-1,所以物质的量的变化量为1.2mol,所以y>1.2,故A错误;
B、加入稀有气体,体系压强增大,但反应体系中各组分的浓度不变,反应速率不变,故B正确;
C、平衡状态时v正(A)=3v逆(C),所以v正(A)>v逆(C),可能为平衡状态,故C错误;
D、混合气体的密度一直不变,所以不一定是平衡状态,故D错误;
故选B.
点评 本题考查了化学键和化合物的关系,明确离子化合物和共价键化合物的概念是解本题关键,注意:并不是所有的物质中都含有化学键,稀有气体中不含化学键,为易错点.


科目:高中化学 来源: 题型:解答题
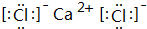 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
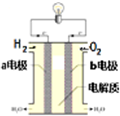 能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.
能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅤⅠA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | ||
| 4 | L | M |
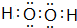 .该物质可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为H2O2+CN-+OH-═CO32-+NH3↑.
.该物质可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为H2O2+CN-+OH-═CO32-+NH3↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
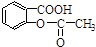 转变为
转变为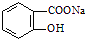 的方法为( )
的方法为( )| A. | 与稀H2SO4共热后,加入足量的Na2CO3 | |
| B. | 加入足量的NaOH溶液,再通入足量的HCl | |
| C. | 与足量NaOH的溶液共热后,再通入CO2 | |
| D. | 与稀H2SO4共热后,加入足量的NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去甲烷气体中的乙烯可以将混合气体通过盛有足量酸性高锰酸钾溶液的洗气瓶 | |
| B. | 苯的二氯代物有3种,说明苯分子是由6个碳原子以单双键交替结合而成的六元环结构 | |
| C. | 乙酸和乙醇在浓硫酸作用下可以反应,该反应属于加成反应 | |
| D. | 乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
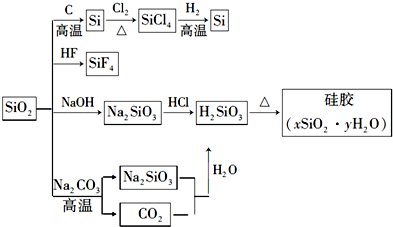
| A. | SiO2属于两性氧化物 | |
| B. | 盛放Na2CO3溶液的试剂瓶不能用玻璃塞 | |
| C. | 硅胶吸水后不能重复再生 | |
| D. | 图中所示转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷中混有的乙烯可通过酸性高锰酸钾溶液来除去 | |
| B. | 除去乙酸乙酯中的乙酸,先加入饱和Na2CO3溶液再分液 | |
| C. | 加稀硫酸的淀粉水解实验的溶液中,加入新制的氢氧化铜并加热以确定水解产物葡萄糖 | |
| D. | 用水能鉴别乙醇、甘油和四氯化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com