分析:(1)①根据△H-T△S判断是否自发进行;
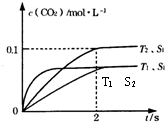
②由图可知,T
2温度平衡时,二氧化碳的浓度变化量为0.1mol/L,根据v=
计算计算v(CO
2),再根据速率之比等于化学计量数之比计算v(N
2);
③接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S
1>S
2,S
2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T
1到达平衡时相同;
④A、到达平衡后正、逆速率相等,不再变化;
B、到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
C、t
1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
D、到达平衡后各组分的含量不发生变化;
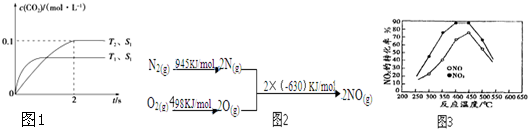
(2)①根据图2写出热化学方程式,利用甲烷燃烧热写出热化学方程式,根据1mol水蒸气变成液态水放热44kJ写出热化学方程式,再利用盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式;
②根据化学平衡移动影响因素判断;
(3)①根据图象中氮氧化物的转化率变化趋势判断;根据图象中,两种氮氧化物转化率大小判断;
②根据甲烷与氮氧化物反应方程式和氮氧化物总物质的量,计算NO的物质的量,从而计算出V(NO):V(NO
2).
解答:
解:(1)①根据反应前气体体积大于反应后气体体积,则△S<0,根据图1,可知T
1>T
2,温度越高n(CO
2)越小,则正反应方向△H<0,当△H-T△S<0,即△H<T△S,自发进行,所以应在低温下,才会自发进行,
故答案为:低温下;
②由图可知,T
2温度时2s到达平衡,平衡时二氧化碳的浓度变化量为0.1mol/L,故v(CO
2)=
=0.05mol/(L?s),速率之比等于化学计量数之比,故v(N
2)=0.5v(CO
2)=0.5×0.05mol/(L?s)=0.025mol/(L?s),
故答案为:0.025mol/(L?s);
③接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S
1>S
2,S
2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T
1到达平衡时相同,故c(CO
2)在T
1、S
2条件下达到平衡过程中的变化曲线为:
,
故答案为:

;
④a、到达平衡后正、逆速率相等,不再变化,t
1时刻V
正最大,之后随反应进行速率发生变化,未到达平衡,故a错误;
b、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故b正确,
c、t
1时刻后二氧化碳、NO的物质的量发生变化,t
1时刻未到达平衡状态,故c错误;
d、NO的质量分数为定值,t
1时刻处于平衡状态,故d正确;
故答案为:bd;
(2)①根据图2,旧键断裂吸收能量为:945+498=1443KJ/mol,放出能量为:2×630=1260KJ/mol,则热化学方程式可写为:2NO=O
2+N
2,△H=-1260+1443=183KJ/mol①;甲烷燃烧热为890kJ/mol,可写出热化学方程式为:CH
4(g)+2O
2(g)=CO
2(g)+2H
2O(l),△H=-890kJ/mol②;H
2O(g)=H
2O(l),△H=-44kJ/mol③
;利用盖斯定律可知②+①×2-③×2,可得目标热化学方程式,则△H=-810.1kJ/mol+183/mol×2-(44kJ/mol)×2=-1168 kJ?mol
-1,
故答案为:-1168 kJ?mol
-1;
②A.增加原催化剂的表面积,同时加快正逆反应速率,化学平衡不移动,故A错误;
B.该反应△H<0,正反应方向放热,降低温度向正反应方向进行,可提高转化率,故B正确;
C.减小投料比,则相当于增大了甲烷浓度,可提高NO
2转化率,故C正确;
D.反应前后气体体积之和相同,增大压强化学平衡不发生移动,故D错误;
故选:BC;
(3)①在250℃-450℃时,NO
x转化率随温度升高而增大,说明温度升高有利于反应的正向进行,推知反应未达化学平衡状态,升高温度加快反应速率,故转化率增大;450℃-600℃(温度较高)时,转化率降低,即升高温度,化学平衡向逆反应方向移动,
故答案为:在250℃-450℃时,NO
x转化率随温度升高而增大:反应未建立平衡,温度升高反应一定正向进行;450℃-600℃(温度较高)时,反应已达平衡,所以,温度升高平衡逆向移动,NO
x转化率随温度升高反而减小;
图象中不难看出相同温度下NO转化效率高于NO
2的转化率,故答案为:结论二 相同温度下NO转化效率比NO
2的低;
②甲烷物质的量为:
=1.875mol,氮氧化物总物质的量为:
=5mol,则有n(NO)+n(NO
2)=5mol,
+
=1.875mol,解得:n(NO)=n(NO
2)=2.5mol,V(NO):V(NO
2)=1:1,
故答案为:1:1.

 ,
, ;
;

 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是