
| A����������������ʷ�Ӧ�����ĵ���������ʵ���֮��Ϊ1��1��3 |
| B��������Fe2O3�����ʵ�����ȷ������Fe��FeO�����ʵ����� |
| C��������FeO�����ʵ�����ȷ������Fe��Fe2O3�����ʵ����� |
| D����Ӧ��������Һ�е�Fe2+��Cl-�����ʵ���֮��Ϊ1��3 |
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2Cu+SO2
2Cu+SO2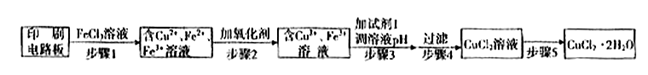 ��֤������I����FeCl3��Һ�����ķ����� ��
��֤������I����FeCl3��Һ�����ķ����� ��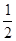 O2��g��==H2O��l�� ��H3=-286kJ/mol
O2��g��==H2O��l�� ��H3=-286kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
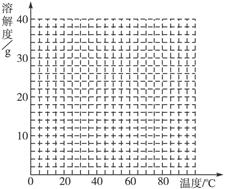
| �¶�/�� | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| �ܽ��/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
| �������� | FeSO4��7H2O | FeSO4��4H2O | FeSO4��H2O | |||||||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��H2SO4 | B����ˮ | C��Zn(NO3)2 | D��H2O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ɫ������BaSO3 | B����ɫ������BaSO4 |
| C����ɫ������BaSO3��BaSO4�Ļ���� | D��FeCl3��ȫ����SO2��ԭ��FeCl2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Ϊ+2�� | B����Ϊ+3�� |
| C��+2��+3�� | D��+2��+4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ٺ͢� | B���ں͢� |
| C���ۺ͢� | D���ٺ͢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���Ȼ��� | B������ͭ | C�������� | D��ϡ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com