
| A. | 难失去电子的原子,易形成阴离子 | |
| B. | 只有化合物分子中才存在共价键 | |
| C. | 共价分子中所有原子都具有8电子稳定结构 | |
| D. | 含氧酸的组成中可以含有金属元素 |
分析 A.稀有气体既难得电子又难失电子;
B.双原子或多原子单质分子中存在共价键;
C.含有H原子的化合物中H原子不满足8电子稳定结构;
D.金属性较弱的金属元素能形成含氧酸.
解答 解:A.稀有气体既难得电子又难失电子,则难失去电子的原子,不一定易形成阴离子,故A错误;
B.双原子或多原子单质分子中存在共价键,如氢气中存在H-H共价键,故B错误;
C.含有H原子的化合物中H原子不满足8电子稳定结构,如HCl中Cl原子满足8电子稳定结构,H原子不8满足电子稳定结构,故C错误;
D.金属性较弱的金属元素能形成含氧酸,如高锰酸,故D正确.
故选D.
点评 本题考查了化学键、8电子稳定结构的判断,题目难度不大,注意对有关概念的把握,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:多选题
| A. | 定量分析--测沸点 | |
| B. | 定性分析--滴入酸性高锰酸钾溶液 | |
| C. | 定量分析--使用银氨溶液 | |
| D. | 定性分析--与新制氢氧化铜悬浊液共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
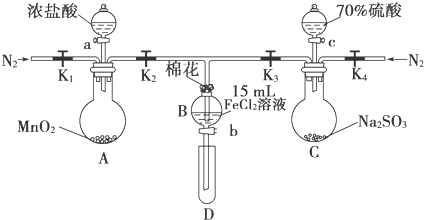
| 过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol/L的CH3COOH溶液与0.1 mol/L CH3COOH溶液中c(H+)之比为2:1 | |
| B. | 0.1 mol/L NaHCO3溶液中,c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 0.1 mol/L 的NaHA溶液,其pH=4,则c(HA-)>c(A2-)>c(H2A) | |
| D. | 只含Na+、CH3COO-、H+、OH-的酸性溶液中,c(H+)>c(CH3COO-)>c(Na+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| (1) |  | 实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为管壁内有淡黄色固体生成;硫化亚铁处加水的目的是稀释浓硫酸,防止硫化氢被氧化. |
| (2) |  | 实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y型管中应放置的药品是浓氨水、碱石灰(固体NaOH、生石灰)(必要时可以加热),该沉淀的化学式为BaSO3. |
| (3) |  | 实验目的:探究电石气中的成分 ①装置A中的化学反应方程式为: CaC2+2H2O→Ca(OH)2+CH≡CH↑. ②B装置中出现黑色沉淀,可判断电石气中含有H2S;C装置的作用为除去硫化氢. ③为验证电石气的主要成分,D中盛放酸性高锰酸钾溶液或溴水. |
| (4) |  | 实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是抬高(或移动)水准管位置,使水准管、量气管内液面相平 ②若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则合金中铁的含量为69.14%(保留2位小数,已折算标况). |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 弱碱的浓度大于强酸的浓度 | |
| B. | 原氨水中有1%的含氮微粒为NH4+ | |
| C. | 反应后的溶液呈酸性 | |
| D. | 混合溶液中c(NH4+)+c(NH3•H2O)+c(NH3)=5×10-4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2 是酸性氧化物,能与NaOH溶液反应 | |
| B. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数相等,质量不相等 | B. | 质子数、质量都不相等 | ||
| C. | 分子数、质量分别相等 | D. | 原子数、电子数都相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一个原子轨道上只能有一个电子 | |
| B. | 处在同一原子轨道上的电子运动状态完全相同 | |
| C. | 处在同一能级中的电子(基态)能量一定相同 | |
| D. | 处在同一电子层上的电子(基态)能量一定不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com