
化学与生产和生活密切相关,下列说法正确的是 ( )
A.聚乙烯塑料的老化是因为发生了加成反应
B.煤经过气化和液化等物理变化可转化为清洁燃料
C.合成纤维、人造纤维及碳纤维都属于有机高分子材料
D.利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程
科目:高中化学 来源: 题型:
有机物F是合成一种新型降压药替米沙坦的中间体,可由下图所示的路线合成:

(1)B的结构简式为________________。
(2)反应①~⑤中,属于取代反应的是________;
A—→B的反应类型____________。
(3)C—→D的化学方程式为__________________。浓H2SO4的作用是________;使用过量CH3OH的作用是__________。
(4)E的同分异构体苯丙氨酸经聚合反应形成的高聚物是__________(写结构简式)。
(5)满足下列条件的B的所有同分异构体有________种,其中苯环上只有一个取代基的结构简式:______________。
①含苯环;②含酯基;③能与新制氢氧化铜悬浊液反应生成砖红色沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据如图描述,完成下列问题:
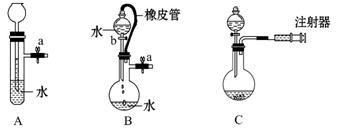
(1)关闭图A装置中的止水夹a,从长颈漏斗向试管中加入一定量的水,静止后如图,判断A装置是否漏气 (填“漏气”“不漏气”或“无法确定”),理由是_______________________________________________________________。
(2)关闭B装置中的止水夹a后,开启活塞b,水不断往下流,至全部流入烧瓶,判断B装置是否漏气 (填“漏气”“不漏气”或“无法确定”),理由是__________________________________________________________________。
(3)用简单的方法检验C装置的气密性__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁电池是一种新型可充电电池,与普 通高能电池相比,该电池能
通高能电池相比,该电池能
长时间保持稳定的 放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
A.放电时负极反应为:3Zn-6e-+6OH-====3Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-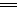 FeO42- +4H2O
FeO42- +4H2O
C.放电时每转移3 mol电子,正极有 1 mol K2FeO4被还原
1 mol K2FeO4被还原
 D.充电时阴极溶液的碱性减弱
D.充电时阴极溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ. (1)人们把拆开1 mol化学键所吸收的能量看成该化学键的键能。
已知N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
查阅资料获知如下反应的热化学方程式。
N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1;
N2(g)+2O2(g)===2NO2(g) ΔH=+68 kJ·mol-1;
2C(s)+O2 (g)===2CO(g) ΔH=-221 kJ·mol-1;
(g)===2CO(g) ΔH=-221 kJ·mol-1;
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1。
①一定条件下,N2与O2反应生成NO能够自发进行,其原因是________,NO分子中化学键的键能为________kJ·m ol-1。
ol-1。
②CO与NO2反应的热化学方程式为4CO(g)+2NO2(g)===4CO2(g)+N2(g) ΔH=________。
Ⅱ.
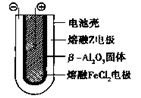
 熔融状态下,
熔融状态下, 钠的单质和FeCl2能组成可充电电池(装置示意图如下),反应原理为:
钠的单质和FeCl2能组成可充电电池(装置示意图如下),反应原理为:
2Na+FeCl2  Fe+2NaCl
Fe+2NaCl
放电时,电池的正极反应式为_______ _______________;
_______________;
充电时,________(写物质名称)电极接电源的负极;该电池的电解质为____ __
查看答案和解析>>
科目:高中化学 来源: 题型:
我国湘黔渝三地交界地区是中国电解锰企业最集中的地区,被称为中国的“锰三角”。金属锰的熔点很高,常用铝热法制得粗锰,再用电解法制得纯的金属锰。铝被用于冶炼金属锰,是因为铝 ( )
A.熔点低
B.具有还原性
C.具有两性
D.冶炼反应中放出大量的热
查看答案和解析>>
科目:高中化学 来源: 题型:
Al2O3、Al(OH)3都是重要化工原料。根据要求回答问题:
Ⅰ、电解法制高品质Al(OH)3装置如右(中间用离子交换膜隔开):
 4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
(1)产物Al(OH)3在 区(填“阴极”或“阳极”)沉积;
(2)电解中转移2mol e—时,将制得__________mol的Al(OH)3。
Ⅱ、制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol·L-1硫酸铝溶液,经检测,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5。(室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(3)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为 m。
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是 。
(5)往溶液中加入H2O2的作用是 (用离子方程式表示)。
(6)加入的X试剂(填选项编号)是 。
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
请回答下列问题:
(1)该反应平衡常数表达式为K=________;ΔH________0(填“>”“<”或“=”)。
(2)830 ℃时,向一个5 L的密闭 容器中充入0.20 mol的A和0.80 mol的B,若测得反应初始至6 s内A的平衡反应速率v(A)=0.003 mol·L-1·s-1,则6 s时c(A)=________mol·L-1;C的物质的量为________mol。
(3)在与(2)相同的温度、容器及A、B配比下反应经一段时间后达到平衡,此时A的转化率为________;如果这时向该密闭容器中再充入1mol氩气,则平衡时A的转化率________(填“增大”“减小”或“不变”)。
(4)判断该反应是否达到平衡的依据为________(填正确选项的字母)。
A.压强不随时间改变
B.气体的密度不随时间改变
C.c(A)不随时间改变
D.单位时间里生成C和D的物质的量相等
(5)1 200 ℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com