

分析 (1)根据拆开1mol某化学键所吸收的能量看成该化学键的键能,结合图示即可解答;根据反应热等于反应物的总键能减去生成物的总键能计算;
(2)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写;
(3)①根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定,以此进行判断;
②根据图象判断出abcd对应的各氢化物,根据焓变的大小书写热化学方程式.
解答 解:(1)由图可知:N≡N键的键能为946kJ•mol-1,反应热=反应物总键能-生成物总键能=946kJ•mol-1+498kJ•mol-1-2×632kJ•mol-1=180 kJ•mol-1,热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180 kJ•mol-1;
故答案为:N2(g)+O2(g)═2NO(g)△H=+180 kJ•mol-1;
(2)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1,
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1;
(3)①非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定,a、b、c、d依次为H2Te、H2Se、H2S、H2O,
故答案为:非金属元素氢化物越稳定,△H越小,反之亦然;
②由①可知,b为硒化氢的生成热数据,则硒化氢分解吸热,且△H=-81kJ/mol,所以H2S发生分解反应的热化学反应方程式为H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol,
故答案为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol.
点评 本题考查了键能、热化学方程式书写、热化学方程式计算等等,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | |||||
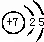 ,③与①所形成的化合物的结构式为:
,③与①所形成的化合物的结构式为: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4Q1+0.5Q2 | B. | 4Q1+Q2+10Q3 | C. | 4Q1+2Q2 | D. | 4Q1+0.5Q2+9Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是烃的衍生物 | B. | 它是含有三种元素的混合物 | ||
| C. | 它的相对分子质量为32 | D. | 它在空气中燃烧只生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | C | |
| B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 与E同主族 |
| C | 1mol C单质能与冷水反应,在标准状况下生成11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负一价阴离子的电子层结构与Ar原子相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | ||
| Y | Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com