
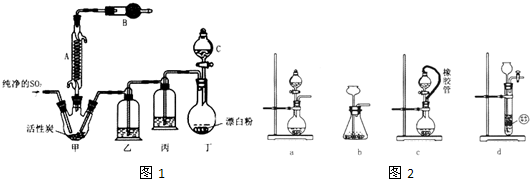
分析 (1)由仪器A的结构特征,可知A为冷凝管;
由反应原理可知,活性炭没有参与反应,应起催化剂作用;
由于SO2Cl2在潮湿空气中“发烟”,装置B的作用是吸收空气中水蒸气,且吸收未反应的二氧化硫与氯气,防止污染空气;
打开分液漏斗上口玻璃塞,平衡气压,再旋转活塞使液体流下;
(2)装置丁制备氯气,浓盐酸与漂白粉反应得到氯化钙、氯气与水;用亚硫酸钠固体和浓硫酸制备二氧化硫气体时,可以通过控制加入硫酸的量(或速度)控制反应速率;
(3)氯磺酸(C1SO3H)加热分解,也能制得硫酰氯(SO2Cl2)与另外一种物质,由元素守恒可知,另外物质含有H元素,C1SO3H中S、Cl原子数目之比为1:1,而SO2Cl2中S、Cl原子数目之比为1:2,故另外物质中含有S元素,结合原子守恒可知另外物质为H2SO4,二者沸点相差较大,采取蒸馏法进行分离;
(4)丁装置制备的氯气中含有HCl、水蒸气,丙装置盛放饱和食盐水,除去混有的HCl,乙装置盛放浓硫酸,干燥氯气,若缺少装置乙,氯气和二氧化硫、水反应生成HCl与硫酸,
提高本实验中硫酰氯的产率,可以控制气体流速,使其充分反应,该反应为放热反应,可以对三颈烧瓶进行适当的降温.
解答 解:(1)由仪器A的结构特征,可知A为冷凝管;
由反应原理可知,活性炭没有参与反应,应起催化剂作用;
由于SO2Cl2在潮湿空气中“发烟”,装置B的作用是吸收空气中水蒸气,且吸收未反应的二氧化硫与氯气,防止污染空气,可以盛放碱石灰;
从仪器C中放出溶液的操作方法是:打开分液漏斗上口玻璃塞,再旋转活塞使液体流下,
故答案为:冷凝管;催化剂;碱石灰;打开分液漏斗上口玻璃塞,再旋转活塞使液体流下;
(2)装置丁制备氯气,浓盐酸与漂白粉反应得到氯化钙、氯气与水,反应离子方程式为:Cl-+ClO-+2H+=Cl2↑+H2O;
a.可以通过旋转活塞,控制滴加硫酸速度,进而可控制反应速率,故a正确;
b.浓硫酸与亚硫酸钠混合,不能控制反应速率,故b错误;
c.橡皮管连接,可以平衡分液漏斗内压强,有利于浓硫酸顺利流下,通过旋转活塞,控制滴加硫酸速度,可控制反应速率,故c正确;
d.亚硫酸钠为粉末且可溶,无法利用简易启普发生器控制,故d错误,
故答案为:Cl-+ClO-+2H+=Cl2↑+H2O;ac;
(3)氯磺酸(C1SO3H)加热分解,也能制得硫酰氯(SO2Cl2)与另外一种物质,由元素守恒可知,另外物质含有H元素,C1SO3H中S、Cl原子数目之比为1:1,而SO2Cl2中S、Cl原子数目之比为1:2,故另外物质中含有S元素,结合原子守恒可知另外物质为H2SO4,反应方程式为:2C1SO3H$\frac{\underline{\;\;△\;\;}}{\;}$SO2Cl2+H2SO4;
二者为互溶液体,沸点相差较大,采取蒸馏法进行分离,
故答案为:2C1SO3H$\frac{\underline{\;\;△\;\;}}{\;}$SO2Cl2+H2SO4;蒸馏;
(4)丁装置制备的氯气中含有HCl、水蒸气,丙装置盛放饱和食盐水,除去混有的HCl,乙装置盛放浓硫酸,干燥氯气,若缺少装置乙,氯气和二氧化硫、水反应生成HCl与硫酸,反应方程式为:Cl2+SO2+2H2O=2HCl+H2SO4;
为提高本实验中硫酰氯的产率,可以控制气体流速,宜慢不宜快,使其充分反应,由于100℃以上SO2Cl2开始分解,该反应为放热反应,可以对三颈烧瓶进行适当的降温,
故答案为:Cl2+SO2+2H2O=2HCl+H2SO4;控制气体流速,宜慢不宜快或对三颈烧瓶进行适当的降温等.
点评 本题考查实验制备方案,涉及对反应原理、装置及操作的分析评价、对仪器的识别、物质的分离提纯等,注意对物质性质信息的应用,难度中等.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
 .
.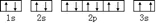 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
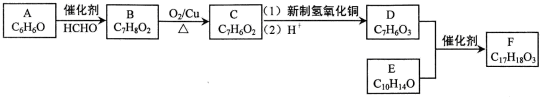
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2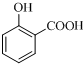 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
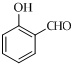
 阿司匹林(又称乙酰水杨酸,
阿司匹林(又称乙酰水杨酸,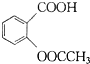 是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实驻室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实驻室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为: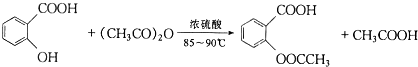
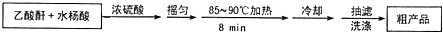
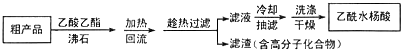
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
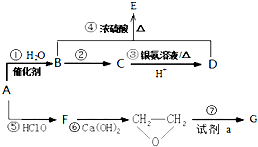 有机物A是石油裂解的主要产物之一,其标准状况下的密度为1.25g/L.反应⑦能缓解目前一个重要的环境问题,生成的聚合物G(C3H4O3)n是一种可降解塑料.有关转化关系如图所示:
有机物A是石油裂解的主要产物之一,其标准状况下的密度为1.25g/L.反应⑦能缓解目前一个重要的环境问题,生成的聚合物G(C3H4O3)n是一种可降解塑料.有关转化关系如图所示: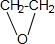 +CaCl2+2H2O.
+CaCl2+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度能加快反应速率 | B. | 使用恰当的催化剂能加快反应速率 | ||
| C. | 增大O2的浓度能加快反应速率 | D. | SO2与O2能100%转化为SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时pH=10的NaOH溶液与pH=10的氨水中:c(Na+)>c(NH${\;}_{4}^{+}$) | |
| B. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) | |
| C. | 在NaHA溶液中(H2A为弱酸):c(Na+)>c(HA-)>c(OH-)>c(H+) | |
| D. | 室温下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(OH-)=c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com