
| 实验步骤 | 实验现象 |
| I.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象. | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象. | 试管中均产生气泡,带火星木条均复燃 |
| III.将实验 II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag. | / |
| IV分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象. | / |
分析 【实验结论】(1)根据氧气具有助燃性,能使带火星的木条复燃进行解答;
(2)实验 III证明,氧化铁的化学性质和质量在反应前后均没有发生变化,可以作过氧化氢分解的催化剂进行解答;
【实验评价】根据实验的过程分析设计实验 IV的目的;
【实验拓展】根据催化剂的性质进行解答.
解答 解:【实验结论】(1)根据氧气具有助燃性,能使带火星的木条复燃,所以产生的现象是A试管中产生气泡,带火星木条复燃,可知A中产生的气体是氧气,
故答案为:氧气;
(2)实验 III证明,氧化铁的化学性质和质量在反应前后均没有发生变化,可以作过氧化氢分解的催化剂,
故答案为:化学性质;质量;
【实验评价】由实验过程可知氧化铁和二氧化锰都能加快过氧化氢的分解,二者可起到对比的作用,
故答案为:进行对比;
【实验拓展】
A.二氧化锰不只能作过氧化氢溶液分解的催化剂,还可以作其它反应的催化剂,故A错误;
B.根据目的信息可知,同一个化学反应可以有多种催化剂,故B正确;
C.催化剂的质量和性质在化学反应前后都不改变,故C正确;
D.用作催化剂的物质可能是其他反应的反应物或生成物,例如二氧化锰是高锰酸钾分解制取氧气的生成物,故D错误,
故答案为:BC.
点评 本题考查了催化剂的特点与催化作用,以及实验室反应制取氧气的原理来解答,锻炼了学生分析问题,解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 淀粉可用于酿酒 | |
| B. | 13g苯中含C-H键的数目是NA | |
| C. | 1mol的金刚石中含4NA根C-C键 | |
| D. | 标准状况下,11.2L甲烷和乙烯的混合物含氢原子数是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | NO中氮氧键 | Cl-Cl键 | Cl-N键 | N=O键 |
| 键能/KJ/mol | 630 | 243 | a | 607 |
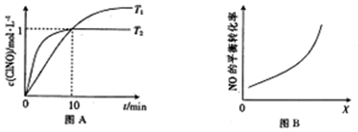
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用漂白精时滴加少量白醋,可提高漂白精的漂白效率 | |
| B. | 用乙醚从黄花篙的汁液中提取青篙素,应用了蒸馏原理 | |
| C. | 古代染坊常用草木灰浸取液来精炼丝绸,该浸取液的主要成分是烧碱 | |
| D. | “地沟油”可用于炼制航空煤油,因为地沟油经过蒸馏可以得到烃类煤油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g乙醛中所含的氧原子数为NA | |
| B. | 足量的铜与40mL10mol/L硝酸反应,生成气体的分子数为0.2NA | |
| C. | 14g乙稀中所含的C-H键数目为2NA | |
| D. | 0.1molNH3中所含的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10Be和9Be是中子数不同质子数相同的不同原子 | |
| B. | 10Be的原子核内中子数比质子数少 | |
| C. | 5.2 g 26Al3+中所含的电子数约为1.2×1024 | |
| D. | 26Al和26Mg的质子数、中子数和核外电子数都不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
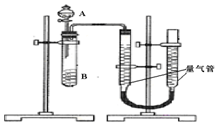 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.| 序号 | A溶液 | B溶液 |
| ① | 2mL0.2mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液 |
| ② | 2mL0.1mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液 |
| ③ | 2mL0.2mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液和少量MnSO4 |
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
| 时间/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26.5 | 27 | 27 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
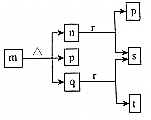 现有三个不同短周期的X、Y、Z、W同种常见元素,其原子序数依次增大,W为金属元素,其余为非金属元素,它们可形成n、q、r三种常见的二元化合物、p、t两种常见三元化合物、m一种常见的四元化合物,它们之间的转化关系如图所示,其中q为无色透明液体,n为无色无味气体,s可使带火星的木条复燃,其余为固体,下列有关说法正确的是( )
现有三个不同短周期的X、Y、Z、W同种常见元素,其原子序数依次增大,W为金属元素,其余为非金属元素,它们可形成n、q、r三种常见的二元化合物、p、t两种常见三元化合物、m一种常见的四元化合物,它们之间的转化关系如图所示,其中q为无色透明液体,n为无色无味气体,s可使带火星的木条复燃,其余为固体,下列有关说法正确的是( )| A. | 离子半径:W+>Z2- | |
| B. | Y的非金属性强于Z,故YX4的热稳定性强于q | |
| C. | n和少量t反应生成m,m还可以和t反应生成p和q | |
| D. | 把少量r投入到FeSO4溶液中,产生无色气体和白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
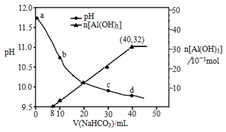 用过量烧碱溶液处理某铝土矿(含Al2O3、Fe2O3),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )
用过量烧碱溶液处理某铝土矿(含Al2O3、Fe2O3),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )| A. | V(NaHCO3)<8mL时,发生的反应为HCO3-+OH-═CO32-+H2O | |
| B. | b点与c点溶液所含微粒种类相同 | |
| C. | NaHCO3溶液的物质的量浓度为0.8 mol•L-1 | |
| D. | 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com