
 某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g).经过5min后,反应达到平衡,此时转移电子6mol.
某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g).经过5min后,反应达到平衡,此时转移电子6mol.分析 (1)某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,经过5min后,反应达到平衡,依据化学方程式可知转移电子4mol消耗CO物质的量为1mol,则此时转移电子6mol,消耗CO物质的量=$\frac{6mol}{4mol}$×1mol=1.5mol,结合化学平衡三段式列式计算
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 2 5 0
变化量(mol) 1.5 3 1.5
平衡量(mol)0.5 2 1.5
平衡浓度c(CO)=$\frac{0.5mol}{2L}$=0.25mol/L,c(H2)=$\frac{2mol}{2L}$=1mol/L,c(CH3OH)=$\frac{1.5mol}{2L}$0.75mol/L
平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
甲醇表示的反应速率v(CH3OH)=$\frac{△c}{△t}$
若保持体积不变,再充入2molCO和1.5molCH3OH,计算此时浓度商Qc和平衡常数大小比较判断平衡的进行方向;
(2)在其它条件不变的情况下,再增加2molCO与5molH2,相当于增大压强,平衡正向进行;
(3)反应是气体体积减小的放热反应,反应达到平衡的标志是正逆反应速率相同,各组分含量保持不变,分析选项中变量不变说明反应达到平衡状态,否则不能达到平衡;
(4)相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大,反应自发进行的判断依据是△H-T△S<0,满足此关系,分析反应的焓变和熵变大小分析判断;
(5)根据化学反应速率和化学平衡的影响因素进行判断,
A.及时分离除CH3OH,减少生成物浓度速率减小,平衡正向进行;
B.升高温度,平衡逆向移动,故速率增大;
C.增大H2的浓度,反应物浓度增大化学反应速率加快,平衡正向移动;
D.催化剂改变化学反应速率,平衡不移动.
解答 解:(1)某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,经过5min后,反应达到平衡,依据化学方程式可知转移电子4mol消耗CO物质的量为1mol,则此时转移电子6mol,消耗CO物质的量=$\frac{6mol}{4mol}$×1mol=1.5mol,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 2 5 0
变化量(mol) 1.5 3 1.5
平衡量(mol)0.5 2 1.5
平衡浓度c(CO)=$\frac{0.5mol}{2L}$=0.25mol/L,c(H2)=$\frac{2mol}{2L}$=1mol/L,c(CH3OH)=$\frac{1.5mol}{2L}$0.75mol/L
平衡常数K=$\frac{0.75}{0.25×{1}^{2}}$=3;
甲醇表示的反应速率v(CH3OH)=$\frac{\frac{1.5mol}{2L}}{5min}$=0.15mol/(L•min),
若保持体积不变,再充入2molCO和1.5molCH3OH,计算此时浓度商Qc=$\frac{\frac{(1.5+1.5)mol}{2L}}{\frac{(0.5+2)mol}{2L}×(1mol/L)^{2}}$=1.2<3
说明平衡正向进行,此时v正>v负;
故答案为:3;0.15;>;
(2)在其它条件不变的情况下,再增加2molCO与5molH2,相当于增大压强,CO(g)+2H2(g)?CH3OH(g),反应是气体体积减小的反应,平衡正向进行,一氧化碳的转化率增大;
故答案为:增大;
(3)CO(g)+2H2(g)?CH3OH(g)△H<0,反应是气体体积减小的放热反应,反应达到平衡的标志是正逆反应速率相同,各组分含量保持不变,分析选项中变量不变说明反应达到平衡状态;
a.CH3OH的质量不变,物质的量不变,说明反应达到平衡状态,故a不符合;
b.反应前后气体质量不变,反应前后气体物质的量变化,当混合气体的平均相对分子质量不再改变,说明反应达到平衡状态,故b不符合;
c.反应速率之比等于化学方程式计量数之比,属于正反应速率之比,2v正(CO)=v正(H2),当满足2v逆(CO)=v正(H2)说明氢气的正逆反应速率相同,反应达到平衡状态,但v逆(CO)=2v正(H2)不能说明反应达到平衡状态,故c符合;
d.反应前后气体质量不变,容器体积不变,混合气体的密度始终不发生改变,不能说明反应达到平衡状态,故d符合;
故答案为:c d;
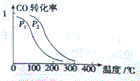
(4)相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大,根据图象知,p1小于p2,温度升高一氧化碳转化率减小,说明升温平衡逆向进行,逆反应为吸热反应,正反应为放热反应,△H<0,CO(g)+2H2(g)?CH3OH(g)反应是气体体积减小的反应,△S<0,反应自发进行的判断依据是△H-T△S<0,满足此关系低温下能自发进行;
故答案为:小于;<;低温;
(5)CO(g)+2H2(g)?CH3OH(g)△H<0,反应是气体体积减小的放热反应,采取下列措施,其中能使该反应的反应速率增大,且平衡向正反应方向移动;
a.及时分离除CH3OH,减少生成物浓度,平衡正向进行,但反应速率减小,故错误;
b.升高温度,平衡逆向移动,故错误;
c.增大H2的浓度,化学反应速率加快,平衡正向移动,故正确;
d.选择高效催化剂,化学反应速率加快,平衡不移动,故错误,
故答案为:c.
点评 本题考查了化学平衡影响因素,反应速率、平衡常数概念计算应用,化学平衡标志的分析判断,掌握基础是解题关键,题目难度中等.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:选择题
| A. | 向AgCl悬浊液中加入KBr溶液:Ag++Br-=AgBr | |
| B. | 用铁棒作阴极、碳棒作阳极电解饱和氯化镁溶液:2C1-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸:2OH-+CO32-+4H+═CO2↑+3H2O | |
| D. | 在强碱性溶液中NaClO与Fe(OH)3生成Na2FeO4:4OH-+3ClO-+2Fe(OH)3═2FeO43-+3C1-+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯能使酸性KMnO4溶液褪色 | |
| B. | 甲醛与苯酚反应能形成高分子化合物 | |
| C. | 乙醇和苯酚都是电解质 | |
| D. | 将乙醇与浓硫酸共热产物直接通入KMnO4溶液中,以证明产物是乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
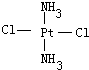 ,黄绿色固体:
,黄绿色固体: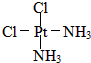 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图1
图1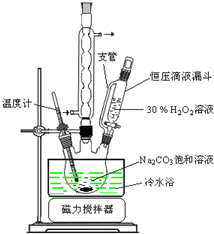
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
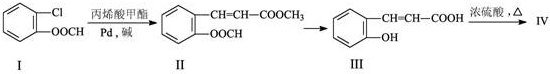
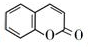
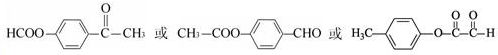
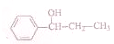 的化学方程式(无机试剂任选)
的化学方程式(无机试剂任选)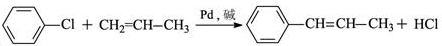 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
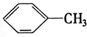 ②
②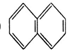 ③
③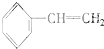 ④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦
④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦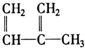 ⑧
⑧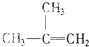
| A. | ⑦和⑧ | B. | ⑤和⑦ | C. | ①、②和③ | D. | ④、⑥和⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y |
| A | Al | NaOH溶液 |
| B | NO2 | H2O |
| C | Na2O2 | CO2 |
| D | Fe | H2O(g) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com