
将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)  2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
A.2v(NH3)=v(CO2)
B.密闭容器中c(NH3)∶c(CO2)=2∶1
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
科目:高中化学 来源:2014高考名师推荐化学周期表、核素(解析版) 题型:实验题
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。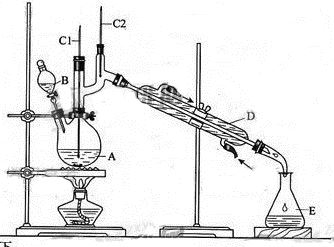
发生的反应如下:
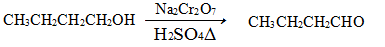
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 11.72 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由 。
(2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法是 。
(3)上述装置图中,B仪器的名称是 ,D仪器的名称是 。
(4)分液漏斗使用前必须进行的操作是 (填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在 层(填“上”或“下”)
(6)反应温度应保持在90—95℃,其原因是 。
(7)本实验中,正丁醛的产率为 %。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学原电池四种型与金属腐蚀、保护(解析版) 题型:选择题
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2作溶剂,反应原理是4Li+FeS2=Fe+2Li2S。下列说法不正确的是

A.该装置将化学能转化为电能
B.电子移动方向是由a极到b极
C.可以用水代替SO(CH3)2做溶剂
D.b极反应式是FeS2+4Li++4e-=Fe+2Li2S
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学平衡常数(解析版) 题型:选择题
在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)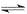 Ni(CO)4(g),已知该反应平衡常数与温度的关系下表,下列说法正确的是
Ni(CO)4(g),已知该反应平衡常数与温度的关系下表,下列说法正确的是
温度℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.25℃时反应Ni(CO)4(g)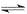 Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)>v(逆)
D.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2mol/L
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学平衡常数、等效平衡(解析版) 题型:填空题
一定温度下,在一个10 L密闭容器中发生某可逆反应,其平衡常数表达式为K= 。请回答下列问题。
。请回答下列问题。
(1)该反应的化学方程式为__________________________________________;
若温度升高,K增大,则该反应是________反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是________(填字母序号)。
A.v正(H2O)=v逆(H2)
B.容器中气体的平均相对分子质量不随时间改变
C.消耗n mol H2的同时消耗n mol CO
D.容器中物质的总物质的量不随时间改变
(3)该反应的v正随时间变化的关系如图,在t2时改变了某种条件,改变的条件可能是________、________。

(4)实验测得t2时刻容器内有1 mol H2O(g),5 min后H2O(g)的物质的量是0.8 mol,这5 min内H2O(g)的平均反应速率为________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学平衡图像(解析版) 题型:选择题
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq);某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法中不正确的是
I3-(aq);某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法中不正确的是

A.反应I2(aq)+I-(aq) I3-(aq)的△H<0
I3-(aq)的△H<0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1﹥K2
C.若反应进行到状态D时,一定有v正﹤v逆
D.状态A与状态B相比,状态B的c(I2)大
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学元素周期表及其应用(解析版) 题型:选择题
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知

A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性大于Y
D.Z元素单质在化学反应中只表现氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com