
【题目】下列物质的电子式书写不正确的是
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,第一步反应生成的沉淀经第二步反应后质量增加的是
A. 将少量FeCl2溶液加入到NaOH溶液中,再滴加H2O2溶液
B. 将少量AgNO3溶液滴加到NaBr溶液中,再滴加Na2S溶液
C. 将少量CO2(g)通入饱和Ca(OH)2溶液中,再通入过量Cl2(g)
D. 将少量Ba(OH)2溶液滴加到入A12(S04)3溶液中,再加入过量NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生活中用途比较广泛。
(1)高铁酸钠(Na2FeO4)是一种新型的绿色消毒剂和高容量电池材料。将Fe(NO3)3与NaClO混合后,在碱性条件下发生反应可制得高铁酸钠,该反应的离子方程式为_____________________________________。
(2)四氧化三铁(Fe3O4)常用作颜料、磁流体材料、催化剂和电子材料等。共沉淀法是目前制备纳米Fe3O4的重要方法之一,其流程如图所示:
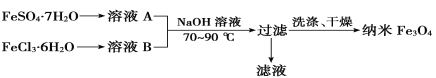
①为得到较纯净的纳米Fe3O4,FeSO4·7H2O与FeCl3·6H2O的物质的量之比最好为________。但实际操作时,却很难控制这一比例,原因是___________________________________________。
②在最佳投料比条件下,检验Fe3O4是否沉淀完全的实验操作是_________________________。
(3)绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。测定绿矾产品中FeSO4·7H2O含量的方法如下:
a.称取3.0 g绿矾产品,配制成250.00 mL溶液;
b.量取25.00 mL a中溶液于锥形瓶中;
c.用0.01000 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液的平均体积为20.00 mL。滴定时发生反应的离子方程式为5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O。
①滴定终点的现象是_______________________________________________________________________。
②产品中FeSO4·7H2O的质量分数为________(小数点后保留1位数字)。
③若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),可能的原因有________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在剧烈运动或过热出汗后,及时补充电解质对保持健康很重要,下列关于电解质的说法错误的是
A.酸、碱、盐都是电解质
B.电离时产生的阴离子只有OH-的电解质是碱
C.在水溶液中或熔融状态下能导电的化合物是电解质
D.由于氧化钠溶于水生成钠离子和氢氧根离子,因而氧化钠是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组实验探究KI和FeCl3生成KCl、I2和FeCl2的反应存在一定限度。
实验:i.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCl3溶液。充分反应后,将所得溶液分成甲、乙、丙三等份;
ⅱ.向甲中滴加CCl4,充分振荡;
ⅲ.向乙中滴加试剂X。
(1)将KI和FeCl3反应的离子方程式补充完整。_____I-+___Fe3+![]() ______I2+_______Fe2+
______I2+_______Fe2+
(2)步骤ⅲ中,试剂X是_____________。
(3)步骤ⅱ和ⅲ的实验现象中,能说明①中反应存在一定限度的实验现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,写出表示硫的燃烧的热化学方程式_____________________________________。
(2)如图是298 K、101 kPa时,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应:I2(g)+H2(g) ![]() 2HI(g)(正反应吸热)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中所列出的条件,其他条件不变,试将化学反应速率的改变(“增大”、“减小”或“不变”)填入相应的表格。
2HI(g)(正反应吸热)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中所列出的条件,其他条件不变,试将化学反应速率的改变(“增大”、“减小”或“不变”)填入相应的表格。
编号 | 反应条件 | 反应速率 |
(1) | 降低温度 | ____________ |
(2) | 加入催化剂 | _____________ |
(3) | 再充入a mol H2 | _____________ |
(4) | 将容器容积扩大为原来2倍 | ___________ |
(5) | 通入b mol Ne(g) | __________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:

回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________________;得到滤渣1的主要成分为________________。
(2)第②步加入H2O2的作用是______________________________________,使用H2O2的优点是______________________________________________;调节pH的目的是使_______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_______________________。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
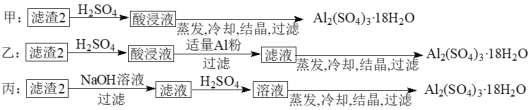
上述三种方案中,______方案不可行 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两个装置,下列说法错误的是( )
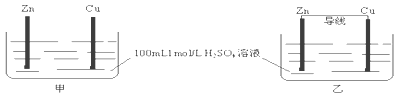
A. 甲、乙装置中,Zn的质量均减小B. 甲、乙装置中,Cu上均有气泡产生
C. 化学反应速率乙>甲D. 甲中H+移向Zn,乙中H+移向Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com