
【题目】下图是部分短周期元素的常见化合价与原子序数的关系图:

(1)元素A在周期表中的位置__________________________。
(2)用电子式表示D2G的形成过程____________________________,其所含化学键类型为___________。
(3)C2-、D+、G2-离子半径由大到小顺序是____________________(用离子符号回答)。
(4)某同学设计实验证明A、B、F的非金属性强弱关系。
①溶液a和b分别为______________,________________。
②溶液c中的离子方程式为________________________________________。

(5)将0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中:
①转移电子的物质的量为_____________________________________。
②用一个离子方程式表示该反应__________________________________________。
【答案】第二周期第ⅣA族 ![]() 离子键 S2->O2->Na+ 硝酸(或HNO3) 饱和NaHCO3溶液 SiO32-+CO2+H2O=H2SiO3↓+CO32- 0.5 mol 10Na2O2+ 6Al3++ 6H2O=4Al(OH)3+ 2AlO2-+ 5O2↑+ 20Na+
离子键 S2->O2->Na+ 硝酸(或HNO3) 饱和NaHCO3溶液 SiO32-+CO2+H2O=H2SiO3↓+CO32- 0.5 mol 10Na2O2+ 6Al3++ 6H2O=4Al(OH)3+ 2AlO2-+ 5O2↑+ 20Na+
【解析】
由图中化合价可知,A、F的化合价都为+4、-4价,二者同主族,且F的原子序数较大,故A为C元素、故F为Si元素;C的化合价为-2价,没有正化合价,故C为O元素;D的化合价为+1价,处于ⅠA族,原子序数大于O元素,故D为Na元素;E为+3价,原子序数大于Na,则E为Al元素;G的最高正价为+6价、最低价为-2,应为S元素;B的有+5、-3价,处于ⅤA族,原子序数介于C、O之间,则B为N元素,根据以上分析可知:A为C元素、B为N元素、C为O元素、D为Na元素、E为Al元素、F为Si元素、G为S元素。
(1)A为C元素,A在周期表的位置为第二周期第ⅣA族,故答案为:第二周期第ⅣA族;
(2)D为Na元素、G为S元素,Na2S属于离子化合物,含有离子键,用电子式表示形成过程为:![]() ,其含有的化学键为离子键,故答案为:
,其含有的化学键为离子键,故答案为:![]() ;离子键;
;离子键;
(3)C为O元素、D为Na元素、G为S元素,电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->O2->Na+,故答案为:S2->O2->Na+;
(4)由装置图可知,实验原理是利用强酸制备弱酸,硝酸易挥发,为防止干扰应除去,故锥形瓶中产生二氧化碳,应为硝酸与碳酸盐反应,溶液b吸收挥发的硝酸,应为饱和的碳酸氢钠,烧杯中应是二氧化碳与硅酸钠反应生成硅酸,
①由上述分析可知,溶液a为硝酸,溶液b为饱和NaHCO3溶液,故答案为:硝酸(或HNO3);饱和NaHCO3溶液;
②溶液c中的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-,故答案为:SiO32-+CO2+H2O=H2SiO3↓+CO32-;
(5)①Na2O2投AlCl3溶液中,先与水生成氢氧化钠与氧气,反应中过氧化钠起氧化剂、还原剂作用,各占一半,起还原剂的过氧化钠中O元素化合价有-1升高为0价,故0.5molNa2O2反应转移电子为0.5mol×![]() ×2×[0-(-1)]=0.5mol,故答案为:0.5mol;
×2×[0-(-1)]=0.5mol,故答案为:0.5mol;
②将0.5molNa2O2投入100mL3mol/LAlCl3溶液中,生成NaOH1mol、0.25mol氧气,AlCl3溶的物质的量为0.3mol,1:4<n(AlCl3):n(NaOH)=3:10<1:3,故生成Al(OH)3、AlO2-,溶液中溶质为偏铝酸钠、氯化钠,根据电荷守恒可知反应中n(AlO2-)=1mol-0.3mol×3=0.1mol,根据Al元素守恒可知,n[Al(OH)3]=0.3mol-0.1mol=0.2mol,故n[Al(OH)3]:n(AlO2-):n(氧气)=0.2mol:0.1mol:0.25mol=4:2:5,反应离子方程式为:10Na2O2+6Al3++6H2O=4Al(OH)3span>+2AlO2-+5O2↑+20Na+,故答案为:10Na2O2+6Al3++6H2O=4Al(OH)3+2AlO2-+5O2↑+20Na+。


 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】已知:xA(g)+yB(g)![]() zC(g);△H=a。将xmolA和ymolB混合在密闭容器中,在不同温度(T1>T2)及压强(P1>P2)下,C的物质的量n(C)与反应时间(t)的关系如图所示。下列判断正确的是( )
zC(g);△H=a。将xmolA和ymolB混合在密闭容器中,在不同温度(T1>T2)及压强(P1>P2)下,C的物质的量n(C)与反应时间(t)的关系如图所示。下列判断正确的是( )

A.x+y=z;a>0B.x+y>z;a<0
C.x+y<z;a<0D.x+y<z;a>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L密闭容器中,把1mol A和1 mol B混合发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )
xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )
A.x的值为2B.A的转化率为40%
C.B的平衡浓度为0.8 mol/LD.D的体积分数为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.56克Cu完全溶于一定量的浓HNO3中,生成的气体恰好充满500mL的烧瓶,然后将该烧瓶倒置于水中,缓缓通入一定量的氧气后容器内刚好充满水,则通入的氧气为( )
A.0.16gB.0.02molC.0.224gD.0.32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.01mol·L-1的HA溶液滴定20mL浓度为0.01mol·L-1的NaOH溶液,滴定曲线如图所示。下列说法错误的是( )

A. 应选用酚酞作指示剂
B. M点溶液中存在:c(Na+)>c(A-)
C. Ka(HA)≈2×10-8
D. N点溶液中存在:c(OH-)-c(H+)=c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚对苯二甲酸乙二醇酯(PET)俗称涤纶,是一种重要的有机高分子材料。其结构为![]() 。其合成路线如图:
。其合成路线如图:
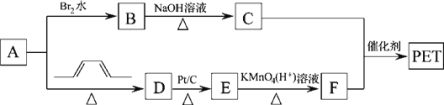
已知:![]()

回答下列问题:
(1)B的名称是__,C中官能团的电子式为__。
(2)A→D的反应类型为___。
(3)E的结构简式为___。
(4)写出C+F→PET的化学反应方程式__。
(5)G是F的同系物,其相对分子质量比F多14,则符合该条件的G的结构共有__种,写出其中苯环上只有一个取代基的结构简式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写下列化学方程式:
(1)丙烯的加聚___;
(2)甲苯制TNT___;
(3)乙醇与浓硫酸共热消去反应___;
(4)乙二醇和乙二酸脱水成六元环的酯___;
(5)乙醛和银氨溶液反应___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的说法正确的是
A.某温度下 c(H+)=![]() 的溶液一定是中性溶液
的溶液一定是中性溶液
B.室温下,向 0.1 mol·L-1 的 CH COOH 溶液中加入少量显碱性的 CH COONa,CH COOH 的电离程度一定增大
C.浓度均为 0.1 mol·L-1 的①(NH4 ) 2CO3 、②NH4HSO4 、③(NH4)2Fe(SO4)2、④NH4 Cl 溶液中,c(NH4+)的大小顺序为①>③>②>④
D.强酸强碱盐的水溶液一定呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在周期表中的位置_____,![]() Mc 的中子数为_____。已知存在P(S,红磷)、P(S,黑磷) 、P(S,白磷),它们互称为_____。
Mc 的中子数为_____。已知存在P(S,红磷)、P(S,黑磷) 、P(S,白磷),它们互称为_____。
(2)热稳定性:NH3_____PH3(填“>”或“<”),砷的最高价氧化物对应水化物的化学式为_____是一种_____酸(填“强”或“弱”) 。
(3)PH3 和卤化氢反应与 NH3 相似,产物的结构和性质也相似。写出 PH3 和 HI 反应的化学方程式_____。
(4)SbCl3 能发生较强烈的水解,生成难溶的 SbOCl,写出该反应的化学方程式_____,因此,配制 SbCl3溶液时应注意_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com