
| A. | 在白磷(P4)晶体中,P原子与P-P键数目比为2:3 | |
| B. | 分子晶体中都存在范德华力,分子内都存在共价键 | |
| C. | HF、HCl、HBr、HI四种物质的沸点依次升高 | |
| D. | 干冰和氯化铵分别受热变为气体所克服的粒子间相互作用属于同种类型 |
分析 A.白磷(P4)晶体中,含4个P原子,为正四面体结构,含6个P-P键;
B.稀有气体形成的分子晶体不含化学键;
C.HF分子间含氢键,沸点最高,其它氢化物相对分子质量越大,沸点越大;
D.干冰变为气体化学键不变,氯化铵分解时离子键、共价键破坏.
解答 解:A.白磷(P4)晶体中,含4个P原子,为正四面体结构,含6个P-P键,则P原子与P-P键数目比为2:3,故A正确;
B.稀有气体形成的分子晶体不含化学键,含范德华力,故B错误;
C.HF分子间含氢键,沸点最高,其它氢化物相对分子质量越大,沸点越大,则HCl、HBr、HI、HF四种物质的沸点依次升高,故C错误;
D.干冰变为气体化学键不变,氯化铵分解时离子键、共价键破坏,则干冰和氯化铵分别受热变为气体所克服的粒子间相互作用不同,故D错误;
故选A.
点评 本题考查化合物与化学键,为高频考点,把握化学键的形成及判断方法为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.


科目:高中化学 来源: 题型:选择题
 金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的 电源.该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH) n.已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能.下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的 电源.该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH) n.已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能.下列说法不正确的是( )| A. | 采用多孔电极的目的是提高电极与电解质溶液 的接触面积,并有利于氧气扩散至电极表面 | |
| B. | M-空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne-═4M(OH)n | |
| C. | 比较 Mg、Al、Zn 三种金属-空气电池,Al-空气电池的理论比能量最高 | |
| D. | 在 Mg-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6和8 | B. | 20和17 | C. | 14和8 | D. | 6和16 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验目的 |
| ①将贝壳煅烧后制成石灰乳. | |
| ②将海水进行浓缩. | |
| ③加入石灰乳沉淀过滤. | 沉淀镁离子生成氢氧化镁沉淀 |
| ④向步骤③所得物质中加入稀盐酸,将溶液进行蒸发浓缩、结晶、过滤. | |
| ⑤将得到的产物干燥除水后,MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑(填化学方程式)得到金属镁. |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1 mol•L-1盐酸和1L mol•L-1硫酸分别与1 L2 mol•L-1NaOH溶液反应速率相同 | |
| B. | 化学反应速率为0.8 mol•L-1•s-1,其含义是时间为1s时,某物质的浓度是0.8mol•L-1 | |
| C. | 0.1 mol•L-1硝酸与相同形状和大小的大理石反应的速率相同 | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象就越明显 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05 mol/(L•s) | B. | 0.10 mol/(L•s) | C. | 0.15 mol/(L•s) | D. | 2.0 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
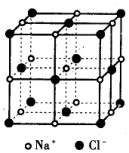 已知NaCl的摩尔质量为58.5g•mol-1,食盐晶体的密度为ρg•cm-3,若图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为58.5g•mol-1,食盐晶体的密度为ρg•cm-3,若图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为( )| A. | 117α3ρ | B. | $\frac{M}{N{α}^{3}}$ | C. | $\frac{234}{{α}^{3}ρ}$ | D. | $\frac{58.5}{2{α}^{3}ρ}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com