
【题目】单质硼是冶金、建材、化工、核工业等部门的重要原料,而金属镁也广泛应用于航空航天等国防军事工业。以铁硼矿为原料,利用碳碱法工艺生产硼和镁,其工艺流程图如下:
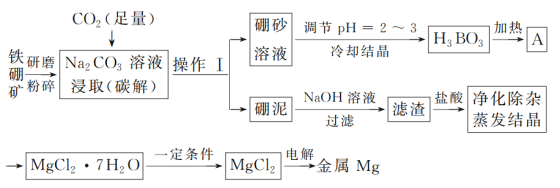
已知:铁硼矿的主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Al2O3和SiO2杂质;硼砂的化学式为Na2B4O7·10H2O。
(1)铁硼矿研磨粉碎的目的是____________;操作Ⅰ的名称为___;硼泥中除杂质SiO2和Al2O3外,其他成分的化学式为_______。
(2)写出流程图中碳解过程的化学方程式:__________;在高温条件下金属Mg与A反应制备单质硼的化学方程式为:__________。
(3)碳碱工艺需两次调节pH:①常用H2SO4调节硼砂溶液pH=2~3制取H3BO3,其离子方程式为B4O72-+2H++5H2O=4H3BO3;②制取MgCl2·7H2O时,在净化除杂过程中,需先加H2O2溶液,其作用是_______,然后用MgO调节pH约为5,其目的是_____。
(4)用MgCl2·7H2O制取MgCl2时,为防止MgCl2水解,反应需在“一定条件下”进行,则该条件是指_____。
(5)实验时不小心触碰到NaOH溶液,可用大量清水冲洗,再涂抹H3BO3溶液中和,其化学方程式为:NaOH+H3BO3=Na[B(OH)4],下列关于Na[B(OH)4]溶液中微粒浓度关系正确的是___。
A c(Na+)+c(H+)=c([B(OH)4]-)+c(OH-)
B c(Na+)>c([B(OH)4]-)>c(H+)>c(OH-)
C c(Na+)=c([B(OH)4]-)+c(H3BO3)
【答案】增大反应物的接触面积;加快化学反应速率;提高原料利用率(任选一条) 过滤 Fe3O4、MgCO3 2Mg2B2O5+Na2CO3+3CO2=Na2B4O7+4MgCO3 3Mg+B2O3![]() 2B+3MgO 将Fe2+氧化为Fe3+ 使Fe3+形成氢氧化物沉淀而除去 干燥的HCl气氛、加热 AC
2B+3MgO 将Fe2+氧化为Fe3+ 使Fe3+形成氢氧化物沉淀而除去 干燥的HCl气氛、加热 AC
【解析】
铁硼矿的主要成分为Mg2B2O5H2O和Fe3O4,含有少量Al2O3和SiO2等,碳解得到硼砂溶液(Na2B4O710H2O),过滤分离,碳解发生反应:2Mg2B2O5H2O+Na2CO3+3CO2=Na2B4O7+2H2O+4MgCO3。硼砂溶液调节pH得到硼酸,加热分解得到A为B2O3。硼泥中含有MgCO3、Fe3O4、Al2O3、SiO2等,加入氢氧化钠溶液,Al2O3、SiO2溶解,滤渣中含有MgCO3、Fe3O4,再用盐酸溶解,得到溶液中含有MgCl2、FeCl2、FeCl3,加H2O2溶液将亚铁离子氧化为铁离子,再调节溶液pH,使铁离子转化为氢氧化铁沉淀过滤除去,滤液经过蒸发浓缩、冷却结晶得到MgCl27H2O,为防止氯化镁水解,在HCl环境下加热失去结晶水,最后电解熔融氯化镁得到Mg。
(1)将铁硼矿研磨粉碎可以增大反应物的接触面积,加快化学反应速率,提高原料的利用率等;铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Al2O3和SiO2)碳解生成硼砂,碳解过程的化学方程式为:2Mg2B2O5+Na2CO3+3CO2=Na2B4O7+4MgCO3,生成的MgCO3以及原料中的Fe3O4、Al2O3和SiO2均不与Na2CO3反应,经过滤后得到硼砂溶液和硼泥;
(2)碳解过程的化学方程式为:2Mg2B2O5+Na2CO3+3CO2=Na2B4O7+4MgCO3;硼酸受热分解的化学方程式为:2H3BO3![]() 3H2O+B2O3,A为B2O3,Mg与B2O3反应制备硼的化学方程式为:3Mg+B2O3
3H2O+B2O3,A为B2O3,Mg与B2O3反应制备硼的化学方程式为:3Mg+B2O3 2B+3MgO;
2B+3MgO;
(3)净化除杂过程中加入H2O2的作用是将Fe2+氧化为Fe3+,其离子方程式为:2H++H2O2+2Fe2+=2Fe3++2H2O,用MgO调节溶液pH约为5,其目的是使Fe3+形成氢氧化物沉淀而除去;
(4)用MgCl2·7H2O制取MgCl2时,为防止MgCl2水解,反应需在干燥的HCl气氛和加热条件下进行;
(5)根据化学方程式NaOH+H3BO3=Na[B(OH)4],可确定溶液中阳离子为H+和Na+,阴离子为[B(OH)4]-和OH-,由电荷守恒:c(Na+)+c(H+)=c([B(OH)4]-)+c(OH-),A项正确;[B(OH)4]-水解使溶液呈碱性,故c(Na+)>c([B(OH)4]-)>c(OH-)>c(H+),B项错误;由物料守恒:c(Na+)=c([B(OH)4]-)+c(H3BO3),C项正确。答案选AC。


科目:高中化学 来源: 题型:
【题目】在常温下,向10mL浓度均为0.1mol·L-1的NaOH和Na2CO3混合溶液中滴0.1mol·L-1的盐酸,溶液pH随盐酸加入体积的变化如图所示。下列说法正确的是
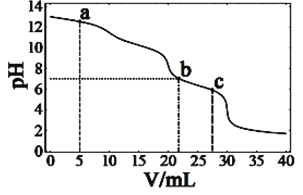
A. 在a点的溶液中,c(Na+)>c(CO32-)>c(Cl-)>c(OH-)>c(H+)
B. 在b点的溶液中,2n(CO32-)+n(HCO3-)<0.001mol
C. 在c点的溶液pH<7,是因为此时HCO3-的电离能力大于其水解能力
D. 若将0.1mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时:c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验对相应的现象解释不正确的是
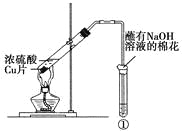
选项 | ①中试剂 | ①中现象 | 解释 |
A | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
B | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
C | 紫色石蕊溶液 | 溶液变红 | SO2与水反应生成酸 |
D | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用HCl滴定NaOH:c(NaOH)=![]() (填“偏大”或“偏小”或“无影响”)。
(填“偏大”或“偏小”或“无影响”)。
(1)酸式滴定管未润洗__________;
(2)碱式滴定管未润洗__________;
(3)锥形瓶用NaOH润洗__________;
(4)锥形瓶洗净后未干燥__________;
(5)酸式滴定管滴定前有气泡,滴定结束后无气泡__________;
(6)滴定时不小心滴到锥形瓶外__________;
(7)振荡锥形瓶时溶液溅出__________;
(8)滴定前仰视,滴定后俯视__________;
(9)滴定前平视,后仰视__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气充电电池有望成为电动汽车的实用储能设备。工作原理示意图如下,下列叙述正确的是
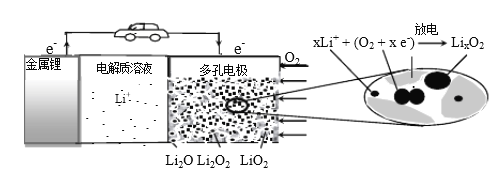
A. 该电池工作时Li+向负极移动
B. Li2SO4溶液可作该电池电解质溶液
C. 电池充电时间越长,电池中Li2O 含量越多
D. 电池工作时,正极可发生: 2Li+ +O2+ 2e-=Li2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]
利用化学方法合成味精的路线如下图所示:
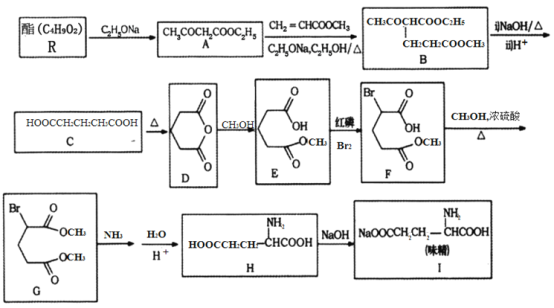
请回答以下问题:
(1)R的结构简式为________;由A生成B的反应类型是________。
(2)F中含氧官能团的名称为________;化合物H的化学名称为________________。
(3)写出由C生成D的化学方程式________________。
(4)写出一种符合下列要求的A的同分异构体的结构简式________。
①结构中含有六元环,光谱测定显示,分子结构中不存在甲基;
②能在NaOH溶液中发生水解反应;
③1mol该物质与足量金属Na反应能够生成0.5mol H2
(5)参照上述合成路线,写出以苯丙酸(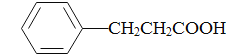 )和甲醇(其它无机试剂任选),设计合成苯丙氨酸(
)和甲醇(其它无机试剂任选),设计合成苯丙氨酸(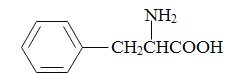 )的路线。_______________________________________________________________________
)的路线。_______________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种有机物甲、乙、丙,其结构如图所示:

下列有关说法中错误的是
A.甲、乙、丙都是芳香族化合物,只有两种能与碳酸氢钠溶液反应
B.只用碳酸氢钠溶液和银氨溶液能检验甲、乙、丙
C.与足量氢气反应,相同物质的量的甲、乙、丙消耗氢气的物质的量之比为3∶4∶3
D.甲的化学式为C11H14O2,乙含有两种含氧官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烧食品中;NH4HSO4在分析试剂、医药、电子工业中用途认识广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是__(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1mol·L-1NH4Al(SO4)2中c(NH4+)__(填“等于”“大于”或“小于”)0.1mol·L-1NH4HSO4中c(NH4+)。
(3)20℃时,0.1mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=__(表达式)。
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。
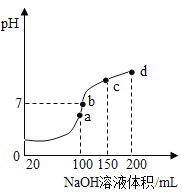
试分析图中a、b、c、d四个点,水的电离程度最大的是___点;在b点,溶液中各离子浓度由大到小的排列顺序是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为___________,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________(填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________。用pH试纸测定该氨水pH的操作方法为_______________________________________________________。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________________________,25 ℃时,氨水电离平衡常数约为___________。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)___________(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。

图中M、Q、N三点所示溶液呈中性的点是___________(填字母,下同)。
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com