
 含乙酸钠和对氯酚
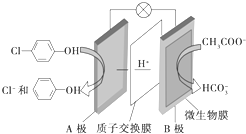
含乙酸钠和对氯酚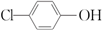 的废水可以利用微生物电池处理,其原理如图所示.下列说法中正确的是( )
的废水可以利用微生物电池处理,其原理如图所示.下列说法中正确的是( )| A. | B极是电池的正极 | |
| B. | H+向A极移动 | |
| C. | B极的电极反应式为CH3COO-+8e-+4H2O═2HCO3-+9H+ | |
| D. | 此电池可以在高温下使用 |
分析 原电池工作时,阳离子向正极移动,则A是正极,正极上发生得电子的还原反应: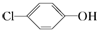 +2e-+H+═
+2e-+H+═ -OH+Cl-,B为负极,反应:CH3COO--8e-+2H2O=2CO2+7H+,以此解答该题.
-OH+Cl-,B为负极,反应:CH3COO--8e-+2H2O=2CO2+7H+,以此解答该题.
解答 解:A.由氢离子的定向移动可知A为正极,B为负极,故A错误;
B.由示意图可知H+从B极移向A极,故B正确;
C.B为负极,发生氧化反应,电极方程式为CH3COO--8e-+2H2O=2CO2+7H+,故C错误;
D.高温条件下,微生物中蛋白质发生变性,故D错误.
故选B.
点评 本题考查新型电池,为高频考点,题目难度不大,注意把握原电池的工作原理以及电极反应式的书写,解答本题的关键是根据物质的性质判断原电池的正负极.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素 | B. | 单质 | C. | 原子 | D. | 氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜器出现铜绿 | B. | 铁制菜刀生锈 | ||
| C. | 大理石雕像被酸雨腐蚀毁坏 | D. | 铝锅表面生成致密的薄膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加醋酸钠固体 | B. | 加HCl溶液 | C. | 加Ba(OH)2溶液 | D. | 加氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | H-N | N═N |
| 键能/kJ•mol | 436 | 391 | 946 |
| A. | +1472kJ•mol-1 | B. | -1472kJ•mol-1 | C. | +92kJ•mol-1 | D. | -92kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质类别 | 具体物质 | 物质类别 | 具体物质 |
| 压缩气体和液化气体 | 氩气、压缩天然气易燃固体、自然物品和遇湿易燃物品 | 硫磺、硝化纤维素、电石、硅钙合金、钠、钾 | |
| 氧化剂和有机过氧化物 | 硝酸钾、硝酸钠、过氧乙酸 | 易燃液体 | 甲乙酮、乙酸乙酯 |
| 腐蚀品、杂类 | 甲酸、磷酸、甲基磺酸、烧碱、硫化碱 | 毒害品 | 氰化钠、甲苯二异氰酸酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com