
| A. | c(H+) | B. | Ka | ||
| C. | c(OH-) | D. | $\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$ |
分析 醋酸为弱酸,稀释过程中醋酸的电离程度增大,溶液中氢离子、醋酸根离子的物质的量增大,醋酸的物质的量减小,由于溶液体积变化程度更大,则溶液中氢离子、醋酸根离子、醋酸的浓度减小;由于水的离子积不变,则溶液中氢氧根离子浓度增大,据此进行解答.
解答 解:A.因CH3COOH为弱酸,则浓度为0.1mol•L-1CH3COOH溶液加水不断稀释,促进电离,平衡正向移动,电离程度增大,n(H+)增大,但c(H+)不断减小,故A错误;
B.因电离平衡常数只与温度有关,则Ka(CH3COOH)在稀释过程中不变,故B错误;
C.溶液中c(H+)•c(OH-)之积为水的离子积,稀释后氢离子浓度减小,氢氧根离子浓度增大,故C正确;
D.稀释过程中,醋酸的电离程度增大,则溶液中的氢离子的物质的量增大、醋酸的物质的量减小,醋酸根离子物质的量增大,由于在同一溶液中,则醋酸与醋酸根离子的浓度的比值减小,故D错误;
故选C.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,注意掌握弱电解质在溶液中的电离平衡及其影响因素,明确醋酸稀释过程中氢离子浓度和氢氧根离子浓度乘积不变.


科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 0.02mol/L的NaOH溶液与0.04mol/L的NaHC2O4溶液等体积混合液:2c(OH-)+c(C2O42-)=c(HC2O4)+2c(H+) | |
| C. | 叠氨酸(NH3)与醋酸酸性相近,0.1mol•L-1 NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+) | |
| D. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
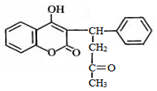
| A. | 分子中有1个手性碳原子 | B. | 遇FeCl3溶液显紫色 | ||
| C. | 1mol杀鼠灵最多能与9molH2反应 | D. | 能发生加成、取代、氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Ca2+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| C. | 水电离出的c(H+)=10-13mol•L-1的溶液中:K+、Na+、SO42-、ClO- | |
| D. | 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铂丝蘸取某未知溶液于酒精灯火焰上灼烧,火焰显黄色,证明该溶液中不含K+ | |
| B. | 向某未知溶液中先滴加氯水,再滴加KSCN溶液,出现血红色,证明溶液中含有Fe2+ | |
| C. | 萃取碘水中的碘时,可以选择苯或四氧化碳作为萃取剂 | |
| D. | 某无色溶液中加入硝酸银溶液后产生白色沉淀,再加入稀盐酸沉淀不消失,证明原溶液中含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | ① | ② | ③ |
| 溶液 | NaClO | NaHCO3 | Na2CO3 |
| pH | 10.3 | 8.3 | 11.6 |
| A. | 酸性:HClO>H2CO3 | |
| B. | 由水电离产生的c(OH-):①>② | |
| C. | 溶液①中的c(ClO-)大于溶液②中的c(HCO3-) | |
| D. | 溶液③中:c(HCO3-)+c(CO32-)=0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠和水反应放热 | B. | 金属钠和水反应产生可燃烧的氢气 | ||
| C. | 可在现场使用干沙灭火 | D. | 可在现场使用高压水枪灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
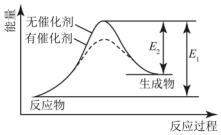
| A. | 该反应为放热反应 | B. | 催化剂改变了化学反应的热效应 | ||
| C. | 催化剂不改变化学反应历程 | D. | 催化剂改变了化学反应历程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com