
| A. | 点燃爆竹后,硫燃烧生成SO3 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| D. | 高铁车厢大部分材料采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强 |
分析 A.S燃烧生成二氧化硫;
B.铜锈与氢离子反应,明矾水解显酸性;
C.水杨酸含-COOH,与碳酸氢钠反应;
D.性质决定用途,合金的硬度大、性能高.
解答 解:A.点燃爆竹后,硫燃烧生成SO2,故A错误;
B.铜锈与氢离子反应,明矾水解显酸性,则利用明矾溶液的酸性清除铜镜表面的铜锈,故B正确;
C.水杨酸含-COOH,与碳酸氢钠反应,则出现水杨酸反应时,用NaHCO3溶液解毒,故C正确;
D.因为铝合金强度大、质量轻、抗腐蚀能力强,则作高铁车厢大部分材料,故D正确;
故选A.
点评 本题考查环境保护及性质与用途,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
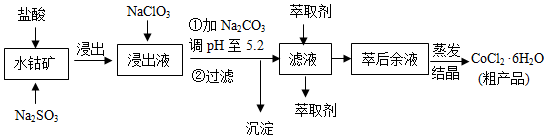
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
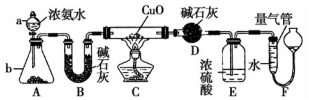 某课外活动小组欲利用CuO与NH4反应,研究NH3的某种性质并测定其组成,设计了如图实验装置(夹持装置未画出)进行实验.请回答下列问题:
某课外活动小组欲利用CuO与NH4反应,研究NH3的某种性质并测定其组成,设计了如图实验装置(夹持装置未画出)进行实验.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
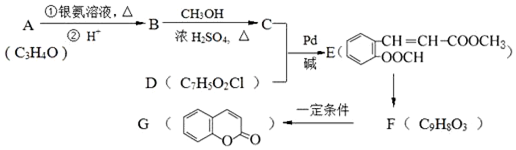

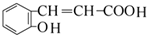 .
.
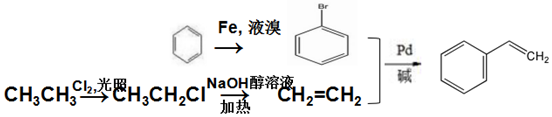 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
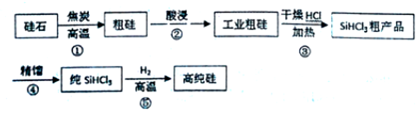
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m+n<p | B. | 平衡向逆反应方向移动 | ||
| C. | A的转化率降低 | D. | C的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定中不慎将锥形瓶内液体摇出少量于瓶外 | |
| B. | 锥形瓶用蒸馏水洗后,用待测夜润洗 | |
| C. | 酸式滴定管用蒸馏水洗后,未用标准液润洗 | |
| D. | 滴定前酸式滴定管尖嘴部分有气泡,滴定完成后气泡消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com