
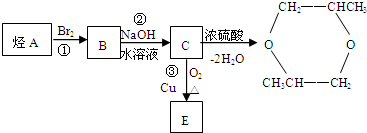
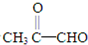 ,据此解答.
,据此解答.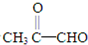 ,
,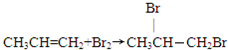 ;
;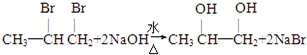 ;
;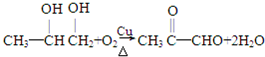 ,
,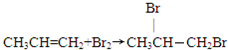 ;
;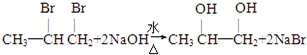 ;
;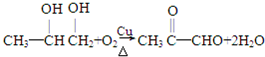 .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
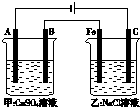 如图为相互串联的甲、乙两个电解池(电极都是惰性电极),请回答:
如图为相互串联的甲、乙两个电解池(电极都是惰性电极),请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇在浓硫酸存在下发生消去反应 |
| B、乙醇与金属钠反应 |
| C、乙醇的酯化反应 |
| D、乙醇在铜丝存在条件下发生催化氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
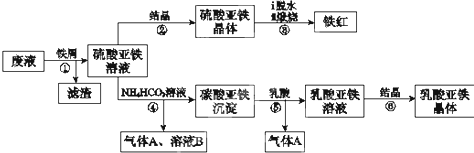
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
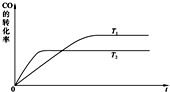 煤间接液化是煤化工的一种重要方法:首先将原料煤与氧气、水蒸汽反应将煤全部气化,制得的粗煤气经变换、脱硫、脱碳制成洁净的合成气(CO+H2),然后合成气在催化剂作用下发生合成反应生成烃类,如:[nCO+(2n+1)H2=CnH2n+2+nH2O];或者合成醇类,如合成甲醇:CO(g)+2H2(g)?CH3OH(g).等等.
煤间接液化是煤化工的一种重要方法:首先将原料煤与氧气、水蒸汽反应将煤全部气化,制得的粗煤气经变换、脱硫、脱碳制成洁净的合成气(CO+H2),然后合成气在催化剂作用下发生合成反应生成烃类,如:[nCO+(2n+1)H2=CnH2n+2+nH2O];或者合成醇类,如合成甲醇:CO(g)+2H2(g)?CH3OH(g).等等.| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com