
 (1)足量镁粉与一定量的盐酸反应,能产生一定量的氢气.由于反应太快,不易操作.为减慢反应速率,但不影响H2的总量,可以加入下列物质中的
(1)足量镁粉与一定量的盐酸反应,能产生一定量的氢气.由于反应太快,不易操作.为减慢反应速率,但不影响H2的总量,可以加入下列物质中的

科目:高中化学 来源: 题型:
| X | |||
| W | Y | R | |
| Z | |||
| A、常温常压下,五种元素对应的单质中有两种是气态 |
| B、Y元素最高价氧化物对应水化物的酸性比W元素的弱 |
| C、Y、Z的阴离子电子层结构都与R原子的相同 |
| D、W的氢化物比X的氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ、有A、B、C、D、E五种溶液分别是HCl、NH3?H2O、NH4HSO4、NaOH、CH3COOH,
Ⅰ、有A、B、C、D、E五种溶液分别是HCl、NH3?H2O、NH4HSO4、NaOH、CH3COOH,| c(B) |
| c(OH-) |
| c(H+) |
| c(OH-) |
| 温度/℃ | 25 | T1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题| 1 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
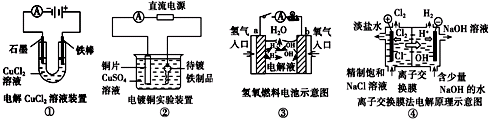
| A、装置①中阳极上析出红色固体 |
| B、装置②的待镀铁制品应与电源负极相连 |
| C、装置③中外电路电子由b极流向a极 |
| D、装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com