
| A. | 甲烷的电子式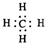 | |
| B. | 氟化钠的电子式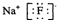 | |
| C. | 硫离子的核外电子排布式 1s22s22p63s23p4 | |
| D. | 碳-12原子 ${\;}_6^{12}$C |
分析 A.甲烷分子中含有4个碳氢键,碳原子最外层满足8电子稳定结构;
B.氟化钠为离子化合物,阴阳离子都需要标出所带电荷,氟离子还需要标出最外层电子;
C.硫离子核外电子总数为18,3p轨道含有6个电子;
D.元素符号的左上角为质量数、左下角为质子数.
解答 解:A.甲烷为正四面体结构,分子中含有4个碳氢键,其电子式为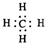 ,故A正确;
,故A正确;
B.氟化钠为离子化合物,钠离子直接用离子符号表示,氟离子需要标出所带电荷及最外层电子,氟化钠的电子式为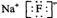 ,故B正确;
,故B正确;
C.硫原子得到2个电子变成硫离子,硫离子最外层满足8电子稳定结构,其正确的和我电子排布式为:硫离子的核外电子排布式:1s22s22p63s23p6,故C错误;
D.碳原子的质子数为6,碳-12原子的质量数为12,该原子可以表示为:${\;}_6^{12}$C,故D正确;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、和我电子排布式、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题侧重基础知识的考查,有利于提高学生的规范答题能力.


科目:高中化学 来源: 题型:实验题
 实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用白糖的主要成分是葡萄糖 | |
| B. | 淀粉溶液和蛋白质溶液都有丁达尔效应 | |
| C. | 油脂、淀粉和纤维素都是人体的重要营养物质 | |
| D. | 植物油的主要成分是高级脂肪酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰溶于水 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | 铁与稀硫酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①③ | B. | 仅②④ | C. | 仅⑤ | D. | 仅③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
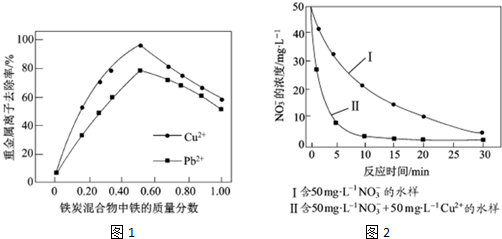
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com