
【题目】 反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
分别如下,其中反应速率最大的是( )
A.v(C)=0.04 mol/(L·s)
B.v(B)=0.06 mol/(L·min)
C.v(A)=0.15 mol/(L·min)
D.v(D)=0.01 mol/(L·s)
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最高的金属元素,其单质及化合物在生产生活中有广泛的应用。
(1)普通水泥的主要成分之一是铝酸三钙(3CaO·Al2O3),3CaO·Al2O3中Al的化合价为__________;
(2)氯化铝广泛用于有机合成和石油工业的催化剂。将铝土矿粉(Al2O3)与炭粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式__________;
(3)现将一定量的铝粉和镁粉的混合物与100mL稀硝酸充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐渐加入4mol·L-1的NaOH溶液,加入NaOH溶液的体积(mL)与产生沉淀的质量的关系如图所示。
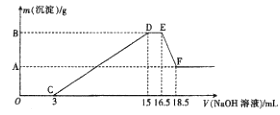
①D→E过程中反应的离子方程式为____________________;
②A点对应纵坐标的数值是__________,原稀硝酸的浓度是__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,在CuZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2 =+41.2kJmol-8平衡常数K2 反应Ⅱ
CO(g)+H2O(g)△H2 =+41.2kJmol-8平衡常数K2 反应Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性;转化的CO2中生成甲醇的百分比
(1)合成的甲醇可用于燃料电池的燃料,若电解质为稀烧碱溶液时甲醇燃料电池的正极反应式为________;研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在______极,该电极反应式是________________________________。
(2)从表中实验数据可以分析出,提高CO2转化成CH3OH的选择性的方法有______________。
(3)反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
(4)在恒压密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图。

①△H1_________0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有___________(填标号)。
A.降低反应温度
B.投料比不变,增加反应物的浓度
C
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I。
①充分反应达到平衡后,若CO2转化率为a,则容器的压强与起始压强之比为________(用a表示)。
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为____________(保留三位有效数字);该温度下反应的化学平衡常数K为____________(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数。写出上述反应压力平衡常数KP为____________(用P0表示,并化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用离子方程式Ba2++SO42- ===BaSO4↓表示的是
A. 氯化钡和硫酸钠溶液反应 B. 碳酸钡和稀硫酸反应
C. 氢氧化钡和硫酸铝溶液反应 D. 氢氧化钡和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的工艺如下:
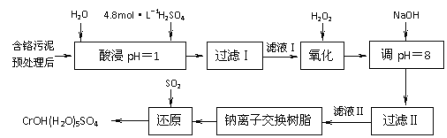
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L―1的浓硫酸配制250 mL 4.8 mol·L―1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需 。
(2)酸浸时,为了提高浸取率可采取的措施有 、 。
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72―,写出此反应的离子方程式: 。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | —— | —— | —— |
沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有 ;但溶液的pH不能超过8,其理由是 。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是 。
(6)写出上述流程中用SO2进行还原的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气排放的NO和CO都是有毒的气体,科学家正在研究利用催化技术将尾气中的NO和CO转变成无毒的CO2和N2,减少污染。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.0 kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221.0 kJ/mol
2C(s)+2O2(g)=2CO2(g) △H=-787.0 kJ/mol
则尾气转化反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= 。
N2(g)+2CO2(g) △H= 。
(2)对于反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),为了测定在某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如下表
N2(g)+2CO2(g),为了测定在某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/×10-4 mol/L | 3.00 | 2.25 | 1.75 | 1.36 | 1.00 | 1.00 |
c(CO)/×10-4 mol/L | 4.00 | 3.25 | 2.75 | 2.36 | 2.00 | 2.00 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率 υ(CO2)= mol/(Ls)。
②在该温度下,反应的平衡常数K= 。
(3)假设在恒容密闭容器中发生上述反应,下列有关说法正确的是 。
A.选用更有效的催化剂能提高尾气的转化率
B.升高反应体系的温度能提高反应速率, 提高尾气的转化率
C.相同温度下,若NO和CO的起始浓度分别为1.50×10-4 mol/L和2.00×10-4 mol/L,平衡时N2的体积分数比原平衡体系中N2的体积分数低
D.单位时间内消耗NO的物质的量等于生成CO2的物质的量时即达平衡状态

(4)用尾气NO2为原料可制新型硝化剂N2O5,原理:先将NO2转化为N2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 不慎打翻燃着的酒精灯,应立即用湿抹布盖灭
B. 金属镁着火时应立即用泡沫灭火器灭火
C. 不小心将浓碱液滴到皮肤上,应立即用大量水冲洗,然后涂点稀硼酸溶液
D. 蒸馏实验时如果蒸馏烧瓶中忘加沸石,应立即停止加热,冷却后补加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种综合处理SO2废气的工艺流程。下列说法正确的是( )

A.向B溶液中滴加KSCN溶液,溶液变为血红色
B.溶液B转化为溶液C发生的变化的离子方程式为4H++2Fe2++O2===2Fe3++2H2O
C.溶液酸性A>B>C
D.加氧化亚铁可以使溶液C转化为溶液A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A.4g固体硫完全燃烧生成SO2,放出37 kJ热量:S(s)+O2(g)=SO2(g) ΔH= -296kJ/mol
B.1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为:
N2(g)+3H2(g)![]() 2NH3(g) △H= -73kJ/mol
2NH3(g) △H= -73kJ/mol
C.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g) ==CO2(g)+ 2H2O(g) ΔH=-890.3kJ·mol-1
D.强酸强碱的中和热为- 57.3 kJ/mol:
Ba(OH) 2(aq)+H2SO4(aq)=BaSO4(S)+2H2O(l) ΔH=-114.6kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com