
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeSO4•7H2O)作还原剂,处理1L废水,至少需要917.4 g | |
| C. | 常温下转化反应的平衡常数K=l×1014.则转化后所得溶液的pH=6 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+ )降至1×10-5mol/L,应调溶液的pH=5 |
分析 A.存在平衡:2Cr O42-(黄色)+2H+?Cr2O72-(橙色)+H2O,如颜色不变,则达到平衡状态;
B.若1L转化后所得溶液中含铬元素的质量为28.6g,根据守恒列关系式:2Cr~2CrO42-~Cr2O72-~2Cr3+~6e-~6FeSO4•7H2O计算;
C.转化时发生的反应为:2CrO42-+2H+?Cr2O72-+H2O,若1L转化后所得溶液中含铬元素的质量为28.6g,CrO42-有$\frac{10}{11}$转化为Cr2O72-,说明铬元素有$\frac{10}{11}$转化为Cr2O72-,计算平衡浓度,结合平衡常数计算;
D.根据溶度积常数列式计算.
解答 解:转化后所得溶液中铬元素含量为28.6g/L,则1L废水中n(Cr)=$\frac{28.6g}{52g/mol}$=0.55mol,
A.存在平衡:2Cr O42-(黄色)+2H+?Cr2O72-(橙色)+H2O,如颜色不变,说明浓度不变,则达到平衡状态,故A正确;
B.若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,设需要xmolFeSO4•7H2O,转化后n(Cr)=$\frac{28.7g}{52}$=0.55mol,由氧化还原反应中氧化剂和还原剂得失电子数目相等可知0.55×(6-3)=x×(3-2),x=1.65,m(FeSO4•7H2O)=1.65mol×278g/mol=458.7g,故B错误;
C.1L废水中n(Cr)=0.55mol,CrO42-有$\frac{10}{11}$转化为Cr2O72-,则转化后c(CrO42-)=0.55mol/L×(1-$\frac{10}{11}$)=0.05mol/L,c(Cr2O72-)=0.55mol/L×$\frac{10}{11}×\frac{1}{2}$=0.25mol/L,常温下转换反应的平衡常数K=1×1014,则$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}(Cr{{O}_{4}}^{2-})•{c}^{2}({H}^{+})}$=1×1014,c(H+)=1×10-6mol/L,所以pH=6,故C正确;
D.常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中c(Cr3+)降至1×10-5mol/L,则c(Cr3+)×c3(OH-)=1×10-32,c(OH-)=1×10-9mol/L,pH=5,故D正确;
故选B.
点评 本题考查难溶电解质的溶解平衡,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意把握相关计算公式的运用,明确难溶物溶解平衡及沉淀转化的本质,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH3的质量为17 g•mol-1 | |
| B. | H2SO4的摩尔质量为98g | |
| C. | 3.01×1023个O3分子和 3.01×1023个O2分子电子数之比等于1:1 | |
| D. | 等物质的量的CO2分子和CO分子的质量比等于11:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
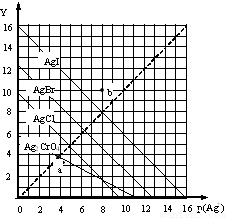 卤化银AgX的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标Y=-lgc(X-).下列说法正确的是( )
卤化银AgX的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标Y=-lgc(X-).下列说法正确的是( )| A. | 该温度下AgCl的Ksp约为1×10-15 | |
| B. | a点时c(Ag+)=c(I-),AgI处于平衡状态 | |
| C. | b点可表示AgBr的不饱和溶液 | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
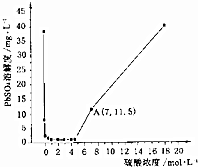 已知25℃时KSP(PbSO4)=1.6×10-8、KSP(BaSO4)=1.1×10-10,该温度下PbSO4在不同浓度的硫酸中的溶解度如图所示.下列有关说法不正确的是( )
已知25℃时KSP(PbSO4)=1.6×10-8、KSP(BaSO4)=1.1×10-10,该温度下PbSO4在不同浓度的硫酸中的溶解度如图所示.下列有关说法不正确的是( )| A. | 图中A点c(SO42-)=7mol•L-1 | |
| B. | 过滤的PbSO4沉淀,用稀硫酸洗涤,可以减少沉淀损耗 | |
| C. | 硫酸浓度大于5mol•L-1时,PbSO4溶解度增大的原因是转化成Pb(HSO4)2 | |
| D. | 将Pb(NO3)2、Ba(NO3)2混合溶液滴入稀硫酸中,能生成PbSO4和BaSO4两种沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙烯(
苯乙烯(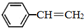 )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ =CH2(g)+H2(g)△=-Q1kJ.mol-1
=CH2(g)+H2(g)△=-Q1kJ.mol-1 .
.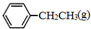 、
、 、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.
、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下,向25mL 0.1mol•L-1 MOH 溶液中逐滴加入0.2mol•L-1 HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol•L-1 MOH 溶液中逐滴加入0.2mol•L-1 HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com