
【题目】已知:①CH3OH(g)+![]() O2(g)===CO2(g)+2H2O(g) ΔH1=-a kJ·mol-1
O2(g)===CO2(g)+2H2O(g) ΔH1=-a kJ·mol-1
②CO(g)+![]() O2(g)===CO2(g) ΔH2=-b kJ·mol-1
O2(g)===CO2(g) ΔH2=-b kJ·mol-1
③H2(g)+![]() O2(g)===H2O(g) ΔH3=-c kJ·mol-1
O2(g)===H2O(g) ΔH3=-c kJ·mol-1
④H2(g)+![]() O2(g)===H2O(l) ΔH4=-d kJ·mol-1
O2(g)===H2O(l) ΔH4=-d kJ·mol-1
下列叙述正确的是( )
A. 由上述热化学方程式可知ΔH3>ΔH4
B. H2的燃烧热为c kJ·mol-1
C. CH3OH(g)===CO(g)+2H2(g) ΔH=( a- b-2c)kJ·mol-1
D. 当CO和H2的物质的量之比为1∶2时,其完全燃烧生成CO2和H2O(l)时,放出Q kJ热量,则混合气中CO的物质的量为![]() mol
mol
【答案】A
【解析】
根据盖斯定律计算反应热,根据燃烧热的概念分析解答。
A. ③ 中产物水为气态,④中产物水为液态,水由液态变为气态需要吸收热量,所以③中放出的热量小于④中放出的热量,即ΔH3>ΔH4,故A正确;
B. 燃烧热应该是1mol的可燃物完全燃烧产生稳定的氧化物所放出的热量,水的稳定状态是液体,而c kJ·mol-1是生成气态水时的反应热,故B错误;
C. 由盖斯定律得:CH3OH(g)===CO(g)+2H2(g)由热化学方程式①-②-2③而来,所以ΔH=( -a+b+2c)kJ·mol-1,故C错误;
D. 由热化学方程式②和④知,当CO和H2的物质的量分别为1mol和2mol时,其完全燃烧生成CO2和H2O(l)时,放出的热量为b+2d kJ,若放出Q kJ热量,则混合气中CO的物质的量为![]() mol,故D错误。
mol,故D错误。
故选A。


科目:高中化学 来源: 题型:
【题目】某温度和有催化剂条件下,恒容密闭容器中发生反应N2+3H2 2NH3,下列说法正确的是( )
t/min | 0 | 5 | 10 | 15 | 20 |
c(NH3)/(mol·L-1) | 0 | 1.00 | 1.60 | 1.80 | 1.80 |
A. 0~10min内,v(NH3)=0.16mol·L-1·min-1 B. 0~10min内,v(N2)=0.18mol·L-1·min-1
C. 0~10min内,v(N2)=0.16mol·L-1·min-1 D. 15~20min内,反应v(N2)正= v(N2)逆=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式__________。
(2)已知在25℃、101kPa下,1 g乙醇在氧气中充分燃烧生成二氧化碳和液态水释放出29.7 kJ的热量,试写出乙醇燃烧热的热化学方程式_______________。
(3)标准状况下,4.48L H2在足量O2中完全燃烧放出热量Q kJ,写出H2燃烧的热化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用平衡移动原理解释的是
A. 用排饱和食盐水的方法收集氯气
B. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率
C. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
D. 锌与稀硫酸反应,加入少量硫酸铜反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是
A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e-
B.O2(g)+4H+(aq)+4e-=2H2O(1)
C.CH3OH(g)+H2O(1)-6e-=CO2(g)+6H+(aq)
D.O2(g)+2H2O(1)+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)![]() 2C(g)达到平衡标志的是
2C(g)达到平衡标志的是
①C的生成速率与C的消耗速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④C的物质的量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a molA,同时生成3a mol B
⑧A、B、C的分子数之比为1:3:2
A. ⑤⑥B. ⑦④C. ①③D. ②⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是( )
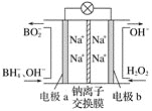
A. 电池放电时Na+从b极区移向a极区
B. 电极b采用MnO2,MnO2既作电极材料又有催化作用
C. 每消耗1 mol H2O2,转移的电子为1 mol
D. 该电池的正极反应为![]() +8OH--8e-===
+8OH--8e-===![]() +6H2O
+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘单质,工艺流程如下。下列关于海带制碘的说法错误的是
干海带![]() 海带灰
海带灰![]() 悬浊液
悬浊液![]() 滤液
滤液![]() 碘水
碘水![]() I2的CCl4溶液
I2的CCl4溶液
A. 实验室灼烧干海带在坩埚中进行
B. 沸水浸泡的目的是使I—充分浸出
C. 由滤液获得碘水,发生的离子反应为2I—+H2O2═I2+2OH—
D. 碘水中加入CCl4得到I2的CCl4溶液,该操作为“萃取”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】闪锌矿(主要成分ZnS,含Cd、Fe、Cu等元素杂质)是冶炼锌单质的原料,有两种常见的冶炼方式:火法炼锌和湿法炼锌。两种方法均先将闪锌矿加热焙烧,得到以ZnO为主要成分的焙砂,再分别经过两条路线得到单质锌,同时得到副产品。
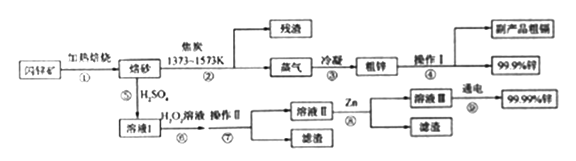
已知:
(I)相关金属单质的熔沸点
金属单质 | Zn | Fe | Cu | Cd |
熔点(K) | 693 | 1812 | 1356 | 594 |
沸点(K) | 1180 | 3023 | 2840 | 1040 |
(II)几种离子生成氢氧化物沉淀的pH
开始沉淀pH | 完全沉淀 pH | |
Fe3+ | l.l | 3.2 |
Zn2+ | 5.9 | 8.9 |
Cu2+ | 4.7 | 6.7 |
Cd2+ | 6.9 | 9.6 |
请回答下列问题:
(1)写出步骤①发生的主要反应的化学方程式___________________。
(2)步骤②若焦炭与ZnO(s)反应生成1mol CO时吸收akJ的热量,请写出该反应的热化学方程示________________。
(3)步骤④中操作I的分离方法为_______,得到副产品粗 镉需控制温度为_____左右。
(4)步骤⑦需调节溶液pH为_______,目的是__________。
(5)步骤⑨以Pt为阳极、Al为阴极进行电解的化学方程式为__________。
(6)分别取闪锌矿200kg,通过火法炼锌得到Zn的质量为65kg,通过湿法炼锌得到Zn的质量为78kg,闪锌矿中ZnS的质量分数约为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com