
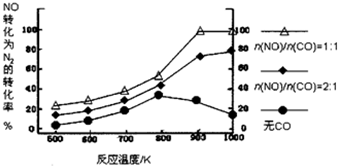
| A. | CO对NO转化为N2起抑制作用 | |
| B. | CO的催化效果随温度升高而提高 | |
| C. | NO的分解反应为放热反应 | |
| D. | $\frac{n(NO)}{n(CO)}$=1时,应控制的最佳温度在1000K |
分析 根据图象分析n(NO)/n(CO)=1时,在相同温度下氮气的转化率最高,而n(NO)/n(CO)=2时,在相同温度下氮气的转化率要低些,无CO时在相同温度下氮气的转化率最低;n(NO)/n(CO)固定时,温度越高氮气的转化率越高;n(NO)/n(CO)=1时,温度在900K左右氮气的转化率已经最高.
解答 解:A、根据图象可知,n(NO)/n(CO)比例为1时,氮气的转化率最高;而n(NO)/n(CO)=2时,在相同温度下氮气的转化率要低些,无CO时在相同温度下氮气的转化率最低,所以CO对NO转化为N2起促进作用,故A错误;
B、根据图象可知,n(NO)/n(CO)固定时,温度越高氮气的转化率越高,所以CO的催化效果随温度升高而提高,故B正确;
C、根据图象可知,n(NO)/n(CO)固定时,温度越高氮气的转化率越高,说明升温平衡向NO的分解方向进行,所以NO的分解反应为吸热反应,故C错误;
D、根据图象可知,n(NO)/n(CO)=1时,温度在900K左右氮气的转化率已经最高,所以应控制的最佳温度在900K,故D错误;
故选:B.
点评 本题考查了图象的分析,涉及化学平衡转化率随温度,原料比的影响,题目难度不大,试题充分培养了学生的分析、理解图象能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 13C与15N有相同的中子数 | B. | 13C与C60互为同素异形体 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3,H2,C4H10? | B. | PCl3,CO2,H2SO4 | C. | SO2,SiO2,P2O5? | D. | CCl4,Na2S,H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 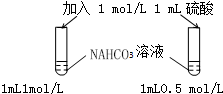 探究浓度对化学反应速率的影响 | B. | 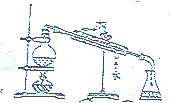 分离乙醇和乙酸的混合溶液 | ||
| C. | 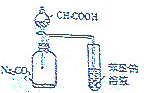 证明酸性:CH3COOH>H2CO3>苯酚 | D. | 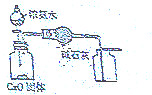 制取并且收集干燥纯净的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24L CO2中含有的原子数为0.3NA | B. | 20g D2O所含的中子数为10NA | ||
| C. | 16g CH4中含C-H键数目为NA | D. | 1 mol 氦气含有的原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 50 | C. | 5×103 | D. | 104 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是共价键 | B. | 一定是离子键 | ||
| C. | 可能是共价键,也可能是离子键 | D. | 可能不形成化学键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com