
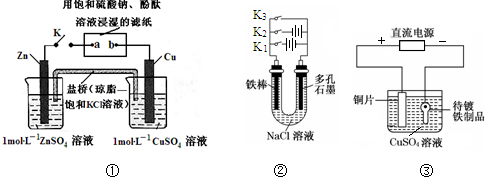
| A. | 装置①中K键闭合时,片刻后可观察到滤纸a点变红色 | |
| B. | 装置①中K键闭合时,片刻后CuSO4溶液中c(Cl-)增大 | |
| C. | 装置②中铁腐蚀的速度由大到小的顺序是:只闭合K1>只闭合K3>只闭合K2>都断开 | |
| D. | 装置③中当铁制品上析出1.6 g铜时,电源负极输出的电子数为0.025 NA |
分析 A.装置①中K键闭合时,Zn为负极,Cu为正极,则a为阴极,b为阳极,阴极上是水放电生成氢气与碱;
B.Y原电池中,阴离子向负极移动;
C.只闭合K1,Fe为阳极,被腐蚀,只闭合K2,Fe阴极,被保护,只闭合K3,为吸氧腐蚀,都断开为化学腐蚀,电化学腐蚀比化学腐蚀快,电解腐蚀比原电池腐蚀的速率更快;
D.根据电子转移守恒计算电源负极输出的电子数.
解答 解:A.装置①中K键闭合时,Zn为负极,Cu为正极,则a为阴极,b为阳极,阴极上是水放电生成氢气与碱,片刻后可观察到滤纸a点变红色,故A正确;
B.装置①中K键闭合时,氯离子向硫酸锌溶液中移动,钾离子向硫酸铜溶液中移动,故B错误;
C.只闭合K1,Fe为阳极,被腐蚀,只闭合K2,Fe阴极,被保护,只闭合K3,为吸氧腐蚀,都断开为化学腐蚀,电化学腐蚀比化学腐蚀快,电解腐蚀比原电池腐蚀的速率更快,故铁腐蚀的速度由大到小的顺序是:只闭合K1>>只闭合K3>都断开>只闭合K2,故C错误;
D.1.6gCu的物质的量为$\frac{1.6g}{64g/mol}$=0.025mol,根据电子转移守恒,电源负极输出的电子数为0.025mol×2=0.05mol,电源负极输出的电子数为0.05 NA,故D错误,
故选:A.
点评 本题考查原电池与电解原理、金属腐蚀与防护,关键是理解原电池与电解池工作原理,掌握电极反应式与判断,注意电子转移守恒再电化学计算中应用.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.1 mol•L-1的AlCl3溶液 | B. | 20 mL 0.1 mol•L-1的CaCl2溶液 | ||
| C. | 30 mL 0.2 mol•L-1的KCl溶液 | D. | 100 mL 0.25 mol•L-1的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B与A只能组成BA3化合物 | |
| B. | 第三周期中,D原子的原子半径最大 | |
| C. | A、B、C三元素不可能形成离子化合物 | |
| D. | E的氧化物对应水化物一定有强的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸,应将水慢慢注入盛有浓硫酸的烧杯中并搅拌 | |
| B. | 酒精灯洒出的酒精万一在桌上着火,应立即用湿抹布扑盖 | |
| C. | 碱溶液沾到皮肤上,应尽快用抹布擦拭干净,再涂上稀盐酸 | |
| D. | 氢气还原氧化铜实验结束时,为节约氢气,应先停止氢气再停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:A>C>B>D | B. | 原子半径:B>D>C>A | ||
| C. | 原子序数:C>B>D>A | D. | 简单离子半径:D>B>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com