
分析 (1)由离子交换关系,氢氧根离子物质的量等于氯离子物质的量等于氢离子物质的量,再计算Fe原子物质的量,根据Fe、Cl原子数目之比计算x的值;
(2)根据元素守恒计算氯化亚铁和氯化铁物质的量之比,进而计算氯化铁质量分数;
(3)FeCl3具有氧化性,再溶液中将二氧化硫氧化为硫酸,自身还原为亚铁离子;
(4)用FeCl3与KClO在强碱性条件下反应制取K2FeO4,氯元素被还原为氯离子,同时有水生成,配平书写离子方程式;
K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,负极为锌失电子发生氧化反应.
解答 解:(1)n(Cl)=n(Cl-)=n(H+)=n(OH-)=0.06L×1 mol•L-1=0.06 mol,则m(Fe)=3.25g-0.06 mol×35.5g•mol-1=1.12g,故 n(Fe)=1.12g÷56g•mol-1=0.02 mol,所以 n(Fe):n(Cl)=0.02:0.06=1:3,即x=3,故答案为:3;
(2)设混合物中FeCl2物质的量为x,FeCl3的物质的量为y,则(x+y):(2x+3y)=1:2.8,得到x:y=1:4,氯化铁物质的量分数=$\frac{4}{1+4}$×100%=80%,故答案为:80%;
(3)FeCl3具有氧化性,再溶液中将二氧化硫氧化为硫酸,自身还原为亚铁离子,反应离子方程式为:SO2+2Fe3++H2O=SO42-+2Fe2++4H+,故答案为:SO2+2Fe3++H2O=SO42-+2Fe2++4H+;
(4)用FeCl3与KClO在强碱性条件下反应制取K2FeO4,氯元素被还原为氯离子,同时有水生成,反应的离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
原电池的正极发生发生还原反应,负极发生氧化反应,负极电极反应为:Zn-2e-+2OH-=Zn(OH)2,正极电极反应式为:2FeO42-+6e-+8H2O=2Fe(OH)3+10OH-,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;3Zn-6e-+6OH-=3Zn(OH)2;2FeO42-+6e-+8H2O=2Fe(OH)3+10OH-.
点评 本题考查滴定计算、混合物计算、离子方程式、原电池等,侧重考查学生综合知识应用能力,需要学生具备扎实的基础,难点是电极反应式书写,难度中等.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:解答题
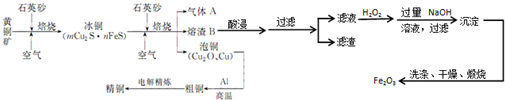
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用燃烧的方法鉴别真丝围巾和纯棉围巾 | |
| B. | 在烹调中加料酒和食醋,增加食物的香味 | |
| C. | 用工业酒精兑制饮用酒出售来提高利润 | |
| D. | 食用加碘盐,预防因缺碘引起的甲状腺肿大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17:5 | B. | 11:3 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
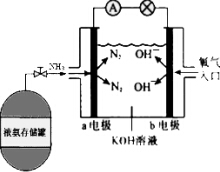 氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,回答下列问题.
氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 | |
| B. | 叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为c(Na+)>c(N3-)>c(OH-)>c(H+) | |
| C. | 常温下,向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
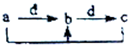 下表各组物质中,物质之间不能通过一步反应实现如图所示转化的( )
下表各组物质中,物质之间不能通过一步反应实现如图所示转化的( )| 物质 选项 | a | b | c | d |
| A | Al | Al(OH)3 | NaAlO2 | NaOH |
| B | C | CO | CO2 | O2 |
| C | NaOH | Na2CO3 | NaHCO3 | CO2 |
| D | AlCl3 | Al(OH)3 | NaAlO2 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com