
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.8 | 2.4 | 0.4 | 放出热量:Q |
| A. | 容器①、②中反应的平衡常数相等,平衡时氮气的转化率相等 | |
| B. | 平衡时,两个容器中NH3 的体积分数均为1/8 | |
| C. | 容器②中达平衡时放出的热量Q=4.63 kJ | |
| D. | 若容器①改为恒压体系,充入0.25 L He,则平衡时放出的热量大于23.15 kJ |
分析 平衡常数只与温度有关;利用反应热计算生成氨气的物质的量,进而根据化学方程式计算生成氨气的体积分数;从平衡移动的角度比较反应放出的热量与23.15kJ的关系.
解答 解:A、平衡常数只与温度有关,相同温度下,体积均为0.25L的两个恒容密闭容器中发生相同的反应,则平衡常数应相同,①②是等效平衡,但①起始氮气的物质的量大,所以转化率小,故A错误;
B、①容器中放出23.15kJ热量,则生成氨气的物质的量为:$\frac{2mol×23.15KJ}{92.6KJ}$=0.5mol,利用三段式法计算:
N2(g)+3H2(g)?2NH3(g)△H=一92.6kJ/mol
起始:1mol 3mol 0
转化:0.25mol 0.75mol 0.5mol
平衡:0.75mol 2.25mol 0.5mol
平衡时,①容器中NH3的体积分数等于气体的物质的量分数$\frac{0.5mol}{0.75mol+2.25mol+0.5mol}$=$\frac{1}{7}$,从等效平衡的角度分析,0.9molN2、2.7molH2和0.2molNH3相当于1molN2、3molH2,在相同条件下处于相同平衡状态,所以平衡时两个容器内氨气的体积分数相等,故B错误;
C、②平衡时生成0.1mol的氨气,而生成2mol的氨气放出热量为:$\frac{92.6×0.1}{2}$=4.63 kJ,故C正确;
D、若若容器①改为恒压体系,充入0.25 L He,相当于在原来的基础上减小压强,平衡逆向移动,平衡时放出的热量小于23.15kJ,故D错误;
故选C.
点评 本题考查化学平衡移动问题,题目难度不大,注意B项从等效平衡的角度分析,为该题的易错点.


科目:高中化学 来源: 题型:解答题
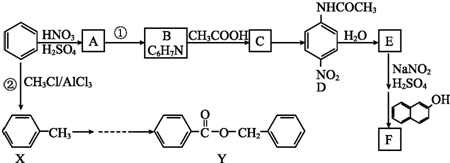
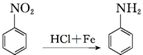
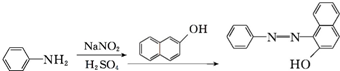
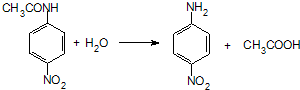 .
.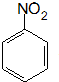 、F
、F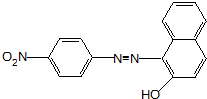 .
.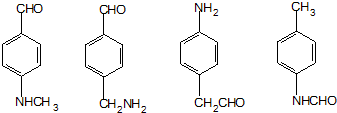 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
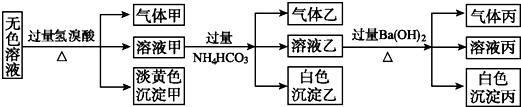
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中的金属都是以化合态形式存在的 | |
| B. | 工业上可利用反应:Mg+2KCl═MgCl2+2K↑进行金属钾的冶炼 | |
| C. | 利用潮汐发电是将化学能转化为电能 | |
| D. | 将海水蒸干可以直接获得食用盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) | |
| B. | 0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| D. | pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
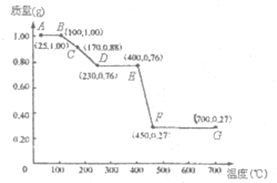 如图是1.00g MgC2O4•nH2O晶体放在坩埚里从25℃徐徐加热至700℃时,所得同体产物的质量(m)随温度(t)变化的关系曲线.(已知100℃以上才会逐渐失去结晶水,并约在230℃时完全失去结晶水)
如图是1.00g MgC2O4•nH2O晶体放在坩埚里从25℃徐徐加热至700℃时,所得同体产物的质量(m)随温度(t)变化的关系曲线.(已知100℃以上才会逐渐失去结晶水,并约在230℃时完全失去结晶水)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com