
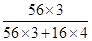 =11.76g,所以根据铁原子守恒可知,钢样中含铁11.76g。
=11.76g,所以根据铁原子守恒可知,钢样中含铁11.76g。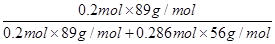 =0.1。
=0.1。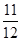 =154g,且带有7mol负电荷
=154g,且带有7mol负电荷

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源:不详 题型:填空题



查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu2+ | B.Fe 2+、Fe3+ | C.Fe 3+、Cu2+ | D.Fe 2+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
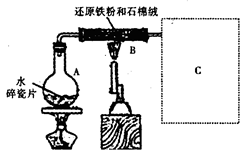
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.14mol | B.0.16mol | C.0.21mol | D.0.24m |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
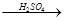 H2
H2 Cu ②CuO
Cu ②CuO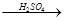 CuSO4
CuSO4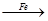 Cu
Cu| A.①多 | B.②多 | C.相等 | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H+ | B.Fe3+ | C.Fe2+ | D.Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com