
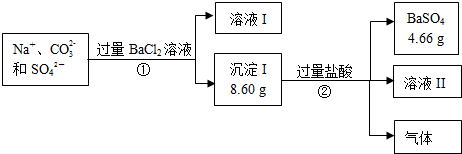
分析 含有含有Na+、CO32-和SO42-的溶液中加入氯化钡溶液,会发生反应Ba2++SO42-═BaSO4↓、Ba2++CO32-═BaCO3↓,则沉淀Ⅰ中8.60g为碳酸钡和硫酸钡的混合物;溶液Ⅰ中含有Ba2+、Na+、Cl-;向沉淀Ⅰ中加入过量盐酸后,碳酸钡溶解,得到的4.66g硫酸钡沉淀,据此可计算出沉淀Ⅰ中碳酸钡沉淀的质量,然后根据n=$\frac{m}{M}$、c=$\frac{n}{V}$计算出碳酸根离子的浓度,据此进行解答.
解答 解:(1)含有含有Na+、CO32-和SO42-的溶液中加入氯化钡溶液,发生反应的离子方程式为:Ba2++SO42-═BaSO4↓、Ba2++CO32-═BaCO3↓,
故答案为:Ba2++SO42-═BaSO4↓;Ba2++CO32-═BaCO3↓;
(2)a.由于氯化钡溶液过量,则溶液I中含有Ba2+、Na+、Cl-,故a正确;
b.若用硫酸代替盐酸,则碳酸钡会转化成硫酸钡沉淀,使计算结果复杂,故b错误;
c.①中不需要配制溶液,则不会用到容量瓶,故c错误;
故答案为:a;
(3)沉淀Ⅰ中8.60g为碳酸钡和硫酸钡的混合物,向沉淀Ⅰ中加入过量盐酸后,碳酸钡溶解,得到的4.66g硫酸钡沉淀,则碳酸钡沉淀的质量为:8.60g-4.66g=3.94g,其物质的量为:$\frac{3.94g}{197g/mol}$=0.02mol,所以原溶液中碳酸根离子的浓度为:$\frac{0.02mol}{0.5L}$=0.04mol/L,
故答案为:0.04mol/L.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意掌握常见离子的检验方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当该电池消耗1mol锌时,与CH4燃料电池消耗0.25molCH4产生电量相等 | |
| B. | 该电池二氧化锰为正极,发生氧化反应 | |
| C. | 当0.1mol Zn完全溶解时,电池外电路转移的电子个数约为1.204×1023 | |
| D. | 电池正极反应式为MnO2+e-+H2O═MnO(OH)+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用容量瓶配制溶液,定容时俯视刻度线所配溶液浓度偏大 | |
| B. | 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 | |
| C. | 在电解精炼粗铜的过程中,当转移电子数为NA时,阳极溶解32g | |
| D. | 催化剂通过降低化学反应的焓变加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${Fe}_{2}{O}_{3}\stackrel{HCl(aq)}{→}{FeCl}_{3}(aq)\stackrel{△}{→}{Fe(OH)}_{3}(胶体)$ | |
| B. | ${Al}_{2}{O}_{3}\stackrel{NaOH(aq)}{→}{NaAlO}_{2}(aq)\stackrel{HCl(aq)}{→}{AlCl}_{3}$ | |
| C. | ${MgCl}_{2}(aq)\stackrel{石灰乳}{→}Mg{(OH)}_{2}\stackrel{煅烧}{→}MgO$ | |
| D. | $Fe{S}_{2}\stackrel{煅烧}{→}{SO}_{3}\stackrel{{H}_{2}O}{→}{H}_{2}{SO}_{4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com