
| A、Na+、Ca2+、Cl-、HCO3- |
| B、Na+、Fe3+、Cl-、HCO3- |
| C、Fe2+、Fe3+、Cl-、NO3- |
| D、Fe2+、Mg2+、Cl-、SO42- |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
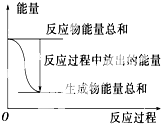
| A、反应过程中能量关系如上图表示,则该反应为放热反应 |
| B、若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
| C、化学反应的焓变与反应方程式的计量数有关 |
| D、若将该反应设计成原电池,锌为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定温度和压强下,各种气态物质的体积大小,由构成气体的分子大小决定的 |
| B、不同的气体,若体积不同,则他们的分子数也不同 |
| C、一定温度和压强下,各种气态物质的体积大小,由构成气体的分子数决定的 |
| D、气体摩尔体积是指1 mol任何气体所占的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试剂X |
2- 4 |
| Ⅰ加盐酸ⅡBaCl2溶液 |
| Ⅲ系列操作 |
| 称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第1份 | 第2份 | |
| 混合物质量(g) | 9.2 | 18.4 |
| 反应后固体质量(g) | 8.3 | 15.6 |
| A、本次实验至少要进行6次称重 |
| B、第1份混合物中NaOH的质量分数更大 |
| C、根据表中数据不能计算出第1份混合物中NaHCO3的质量分数 |
| D、第2份混合物中NaOH的质量分数小于0.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室用0.10mol?L-1的NaOH溶液滴定某一元弱酸HA的滴定曲线如图所示,图中横轴为滴入的NaOH溶液的体积V(mL),纵轴为溶液的pH,下列叙述不正确的是( )
实验室用0.10mol?L-1的NaOH溶液滴定某一元弱酸HA的滴定曲线如图所示,图中横轴为滴入的NaOH溶液的体积V(mL),纵轴为溶液的pH,下列叙述不正确的是( )| A、此一元弱酸HA的电离平衡常数Ka≈1×10-4mol?L-1 |
| B、此弱酸的起始浓度约为1×10-2mol?L-1 |
| C、此实验最好选用酚酞试液(变色范围8.0~10.0)做指示剂 |
| D、当混合液pH=7时,溶液中c(HA)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com