
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
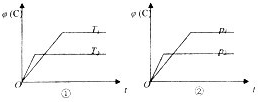 可逆反应聊mA(s)+nB(g)?eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数在φ(C)在不同温度(T)和不同压强(p)的条件下随时间变化如图所示.下列叙述正确的是( )
可逆反应聊mA(s)+nB(g)?eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数在φ(C)在不同温度(T)和不同压强(p)的条件下随时间变化如图所示.下列叙述正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
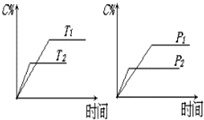
 对于密闭容器中的反应:N2(g)+3H2(g)
对于密闭容器中的反应:N2(g)+3H2(g)  2NH3(g),在673K、30MPa下,n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
2NH3(g),在673K、30MPa下,n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:
自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
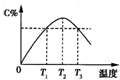 某温度下,在体积为2L的密闭容器中,充入1mol A和a mol B气体,发生如下反应:A(g)+B(g)?2C(g).5min后反应达到平衡时n(A)为0.4mol.在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系曲线如图所示.下列叙述正确的是( )
某温度下,在体积为2L的密闭容器中,充入1mol A和a mol B气体,发生如下反应:A(g)+B(g)?2C(g).5min后反应达到平衡时n(A)为0.4mol.在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系曲线如图所示.下列叙述正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com