
科目:高中化学 来源:不详 题型:单选题

| A.t°C时,Ag2CrO4的Ksp为1×10-8 |
| B.在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 |
| C.t°C时,Y点和Z点的Ag2CrO4的Ksp相等 |
| D.t°C时,将0.01 mol·L-1 AgNO3溶液滴入20 mL 0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.MnS的Ksp比CuS的Ksp大 |
| B.该反应达平衡时c(Mn2+)=c(Cu2+) |
| C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数K= |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B.在100mL MgCO3、CaCO3、MnCO3饱和的混和溶液中加入足量浓K2CO3溶液,产生沉淀MnCO3质量最多 |
| C.b点可表示CaCO3的饱和溶液,且Ca2+浓度与CO32-浓度相等 |
| D.c点若表示MgCO3则为不饱和溶液,若表示CaCO3则有沉淀析出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。
mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.原AgNO3溶液的物质的量浓度为0.1 mol·L-1 |
| B.图中x点的坐标为(100,6 ) |
| C.图中x点表示溶液中Ag+ 与Cl- 浓度相同 |
| D.把0.1 mol·L-1的NaCl换成0.1 mol·L-1NaI则图象在终点后变为虚线部分 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验操作 | 解释或结论 |
| A | 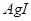 沉淀中滴入浓KCI溶液有白色沉淀出现 沉淀中滴入浓KCI溶液有白色沉淀出现 | 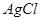 比 比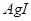 更难溶 更难溶 |
| B | 某物质的水溶液能使红色石蕊试纸变蓝 | 该物质一定是氨气 |
| C | 滴加氯水和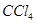 振荡,静置,下层溶液为紫色 振荡,静置,下层溶液为紫色 | 原溶液中有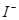 |
| D | 用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 含有Na单质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某离子被沉淀完全是指该离子在溶液中的浓度变为0 |
| B.某物质的溶解性为难溶,则该物质的溶解度为0 |
| C.一般来说,溶解度小的难溶物容易转化为溶解度大的难溶物 |
| D.沉淀的生成、溶解和转化其实质都是沉淀发生了溶解平衡的移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.298K时,CaSO4的溶解度约为7.00×10-2 mol/L |
| B.反应CaSO4(s) + CO32-= CaCO3(s) + SO42-在298K时的平衡常数K= Ksp(CaSO4) / Ksp(CaCO3) = 1.75×104 |
| C.CaCO3、CaSO4的饱和溶液的导电能力很弱,所以它们都是弱电解质 |
| D.升高温度,两种盐的溶度积与溶解度都保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com