
 有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品.其构想分成3个步骤:
有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品.其构想分成3个步骤:分析 (1)已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H1=-285.8kJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2=-889.6kJ/mol
③H2O(l)=H2O(g)△H3=+44.0kJ/mol
根据盖斯定律,①×4-②+③×2可得:CO2(g)+4H2(g)=CH4(g)+2H2O(g);
(2)根据方程式:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑、CO2+4H2=CH4+2H2O,可得关系式2H2 ~O2 ~$\frac{1}{2}$CH4;
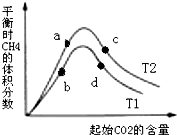
(3)增大二氧化碳的浓度平衡正移,氢气的转化率增大;
平衡常数只与温度有关,正反应为吸热反应,升高温度平衡逆移,K要减小.
解答 解:(1)已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H1=-285.8kJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2=-889.6kJ/mol
③H2O(l)=H2O(g)△H3=+44.0kJ/mol
根据盖斯定律,①×4-②+③×2可得:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-165.6kJ/mol,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-165.6kJ/mol;
(2)根据方程式:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑、CO2+4H2=CH4+2H2O,可得关系式2H2 ~O2 ~$\frac{1}{2}$CH4,故收集11.2L氧气时,可以制得甲烷为11.2L×$\frac{1}{2}$=5.6L,
故答案为:5.6L;
(3)增大二氧化碳的浓度平衡正移,氢气的转化率增大,所以氢气的转化率的大小关系是:a(a)<a(c);
正反应为放热反应,升高温度平衡逆向移动,甲烷的含量减小,故温度T1>T2,而平衡常数只与温度有关,升高温度平衡逆移,K要减小,故平衡常数Ka=Kc>Kb=Kd,
故答案为:<;Ka=Kc>Kb=Kd;
点评 本题考查化学平衡影响因素、化学平衡图象、平衡常数、盖斯定律应用等,(2)中注意利用关系式解答,注意平衡常数只受温度影响.


科目:高中化学 来源: 题型:选择题
| A. | 1mol固态焦炭与1mol水蒸气反应产生1mol一氧化碳和1mol氢气,吸收131.3 kJ的热量 | |
| B. | 碳与水反应吸收131.3 kJ的热量 | |
| C. | 1mol碳和1mol水反应吸收131.3 kJ的热量 | |
| D. | 固态碳和气态水各1mol反应,放出131.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L溶液里含有NA个SO42- | |
| B. | 1L溶液里K+离子数比SO42-离子数少NA个 | |
| C. | 2L溶液里,阴、阳离子的总数大于4NA个 | |
| D. | 2L溶液里,Al3+离子个数一定小于NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com