
| A. | 胃酸过多的病人都可以服用氢氧化钠、氢氧化铝、碳酸钠等中和胃酸的药 | |
| B. | 使用青霉素时,不用进行皮试可直接静脉注射 | |
| C. | 阿司匹林是一种治感冒药,具有解热镇痛作用 | |
| D. | 麻黄碱有止咳平喘的作用,运动员比赛前若身体不适可服用 |
科目:高中化学 来源: 题型:选择题
| A. | 乙醇分子的比例模型: | |
| B. | 蔗糖、麦穿糖、淀粉、纤维素充全水解都只生成葡萄糖 | |
| C. | 《天工开物》中“凡石灰,经火焚炼为用”里的“石灰”指的是Ca(OH)2 | |
| D. | 许多国家十分重视海水资源的综合利用,从海水中可获得的物质有氧、溴、碘、钠、镁、铝、烧碱、氢气、食盐、淡水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2molA 1molB | B. | 2molA 2molB | C. | 2molC 4molD | D. | 2molC 2molD |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于吸热反应,反应物所具有的总能量低于生成物所具有的总能量 | |
| B. | 任何放热反应在常温条件一定能发生反应 | |
| C. | 原电池反应一定是氧化还原反应 | |
| D. | 元素由化合态变成游离态时,它可能被氧化,也可能被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;Y中含有的化学键类型为离子键、共价键
;Y中含有的化学键类型为离子键、共价键查看答案和解析>>
科目:高中化学 来源: 题型:解答题
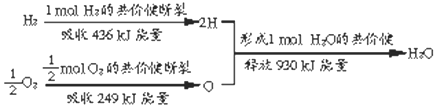
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)═c(SO42-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1 mol/L Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| C. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═2c(HCO3-)+2c(H2CO3)+2c(CO32-) | |
| D. | pH=1的NaHSO4溶液:c(H+)═2c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 a、b、c、d、e、f是原子序数依次增大的6种短周期元素,a、d同主族,a是原子半径最小的元素,b的最高正化合价与最低负化合价的代数和为零,a与c、d与c均可形成原子个数之比为2:1和1:1的化合物,d、e的最外层电子数之和等于b的最外层电子数,f是同周期中得电子能力最强的元素.
a、b、c、d、e、f是原子序数依次增大的6种短周期元素,a、d同主族,a是原子半径最小的元素,b的最高正化合价与最低负化合价的代数和为零,a与c、d与c均可形成原子个数之比为2:1和1:1的化合物,d、e的最外层电子数之和等于b的最外层电子数,f是同周期中得电子能力最强的元素. .a、c、d三种元素形成的化合物中存在的化学键类型是离子键、共价键.
.a、c、d三种元素形成的化合物中存在的化学键类型是离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:6 | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 该化合物中一定含有氧元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com