
分析 16g即1molCH4在氧气中燃烧生成CO2和液态水,放出890kJ热量,则热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol,
(1)n(CH4)=$\frac{112L}{22.4L/mol}$=5mol,据热化学方程式分析得;
(2)据v=nVm进行计算.
解答 解:16g即1molCH4在氧气中燃烧生成CO2和液态水,放出890kJ热量,则热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol,
(1)n(CH4)=$\frac{112L}{22.4L/mol}$=5mol,由热化学方程式得燃烧1molCH4放出890KJ的热量,则燃烧5mol,放出的热量为5mol×890KJ/mol=4450kJ,
答:在25℃,101kPa下,充分燃烧生成液态水时放出的热量4450kJ;
(2)由方程式CH4(g)+2O2(g)═CO2(g)+2H2O得,消耗22.4LCH4生成22.4LCO2,则消耗112LCH4生成112LCO2,
答:同时产生二氧化碳的体积112L.
点评 本题考查热化学方程式的书写、反应热的有关计算,难度不大,注意对基础知识的理解掌握.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:实验题
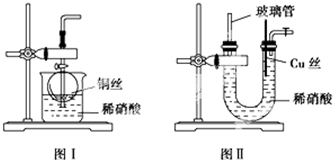
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
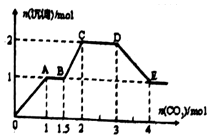 现有易溶强电解质的混合溶液10L,共中可能含K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与遇入CO2的量之问的关系如图所示,下列说法正确的是( )
现有易溶强电解质的混合溶液10L,共中可能含K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与遇入CO2的量之问的关系如图所示,下列说法正确的是( )| A. | 该溶液中能确定存在的离子是Ba2+、Na+、Cl-、NH4+ | |
| B. | 肯定不存在的离子是Cl-、OH- | |
| C. | 若不能确定的离子中至少还存在一种阳离子,则该离子的最小浓度为:0.2mol/L | |
| D. | OA段反应的离子方程式::2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N≡N | N-H |
| 键能/KJ•mol-1 | 436 | 946 | 390.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
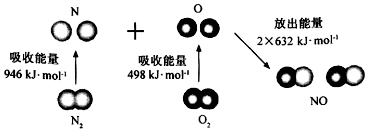
| A. | 直观看,该反应中反应物所具有的总能量低于生成物所具有的总能量 | |
| B. | 2 mol气态氧原子结合生成O2(g)时,能放出498 KJ能量 | |
| C. | 断裂1 mol NO分子中的化学键,需要吸收632KJ能量 | |
| D. | 该反应的热化学方程式为:N2+O2═2NO△H=+180KJ/mol. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
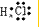 ②⑤
②⑤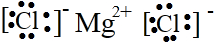 ③⑦
③⑦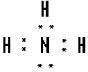
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
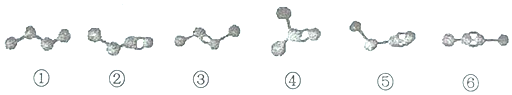
| A. | 烃②、③、④的分子式均为C4H8,三者互为同分异构体 | |
| B. | 烃⑤和⑥的分子式均为C4H6,二者互为同分异构体 | |
| C. | 烃②、③、⑤、⑥分别与足量氧气发生加成反应,均可得到烃① | |
| D. | 等物质的量的烃②和⑤分别在氧气中完全燃烧,烃⑤消耗的氧气多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 溶液温度降低主要是因为NH4HCO3溶解吸热造成的 | |
| C. | 反应物的总能量低于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O-Q |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com