(2010?西城区模拟)某小组同学将一定浓度Na
2CO
3溶液滴入CuSO
4溶液中发现生成了蓝色沉淀.甲同学认为沉淀是CuCO
3;乙同学认为沉淀是CuCO
3和Cu(OH)
2的混合物,他们设计实验测定沉淀中CuCO
3的质量分数.
已知:CuCO
3和Cu(OH)
2均为蓝色,难溶于水.
(1)按照甲同学的观点,发生的反应属于4种基本反应类型中的
复分解反应
复分解反应
.
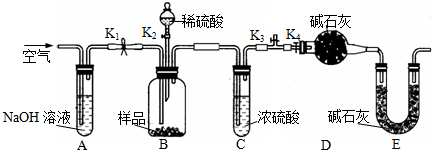
(2)乙同学利用如图所示装置进行测定.
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化.具体操作依次为
过滤
过滤
、洗涤、干燥;
②装置E中碱石灰的作用是
防止空气中CO2和水蒸气进入装置D影响二氧化碳的质量测定
防止空气中CO2和水蒸气进入装置D影响二氧化碳的质量测定
;
③实验过程中有以下操作步骤:
a.关闭K
1、K
3,打开K
2、K
4,充分反应;
b.打开K
1、K
4,关闭K
2、K
3,通入过量空气;
c.打开K
1、K
3,关闭K
2、K
4,通入过量空气正确的顺序是(填选项序号,下同)
cab
cab
.若未进行步骤
b
b
,将使测量结果偏低;
④若沉淀样品的质量为m g,装置D的质量增加了n g,则沉淀中CuCO
3的质量分数为
.
(3)丙同学认为还可以通过测量CO
2的体积或测量
样品质量和样品充分灼烧后的质量
样品质量和样品充分灼烧后的质量
来测定沉淀中CuCO
3的质量分数.




 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 (2010?西城区一模)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
(2010?西城区一模)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
