
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:

下列说法中正确的是
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
科目:高中化学 来源: 题型:
【题目】下列物质①HCl②CO2③H2O④H2⑤NaHSO4⑥Cl2⑦NaF⑧CH4⑨CaO⑩MgCl2
(1)属于离子化合物的是_______,只含共价键的是______,既含有离子键又有共价键的是______。
(2)属于电解质的是__________,属于非电解质的是___________。
(3)将NaHSO4熔化,破坏了NaHSO4中的__________键,写出其电离方程式_____________。将NaHSO4溶于水,破坏了NaHSO4中的_________键,写出其电离方程式_____________。
(4)分别用电子式表示氯化镁、氯气的形成过程:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
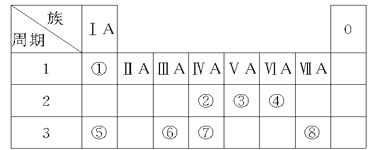
(1)④、⑤、⑥的原子半径由大到小的顺序为(填元素符号)_______。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)________。
(3)①、④、⑤三种元素可形成既含离子键又含共价键的化合物,写出该化合物的电子式________。
(4)②的氧化物的结构式_________;比较②、⑦的氧化物的熔点(填化学式):
______>_______,原因是___________________________________________。
(5)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。
①Be(OH)2与Mg(OH)2可用__________鉴别(填名称)。
②写出Be与NaOH溶液反应生成Na2BeO2的离子方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
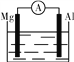
【题目】据图回答下列问题:
①
(1)如图①,若烧杯中溶液为稀硫酸,则观察到的现象是
________________________________________________________________________;
若烧杯中溶液为氢氧化钠溶液,则负极的电极反应式为____________________。
②
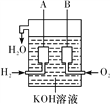
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图②所示:A、B两个电极均由多孔的碳块组成。该电池的正极为________(填“A”或“B”);
如果将图②装置中通入的H2改成CH4气体也可以组成一个原电池装置电池的总反应方程式为CH4+2O2+2KOH===K2CO3+3H2O,则该电池的负极反应式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号都代表一种元素,请根据要求回答问题:
族 周期 | IA | 0 | |||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
2 | ① | ② | Ne | ||||||
3 | ③ | ④ | ⑤ | ⑥ | |||||
(1)元素①的最低价氢化物和最高价氧化物的水化物反应得到一种离子化合物的化学式为________________;
(2)②和⑥两种元素的原子半径大小关系:②________⑥(填“>”或“<”);
(3)③和⑤两种元素的金属性强弱关系:③________⑤(填“>”或“<”),它们的最高价氧化物对应水化物反应的离子方程式为__________________________________________;
(4)④的单质与⑥的最高价氧化物对应的水化物的稀溶液反应的离子方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组,通过下图装置进行硫酸与铜反应的实验探究。
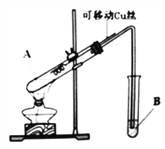
⑴提出假设:
假设一:加热时,稀H2SO4与Cu能反应。
假设二:加热时,浓H2SO4与Cu能反应。
⑵设计实验:
实验编号 | 实验操作 | 实验现象 |
1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
实验前,试管B盛放的是_______________溶液(填“品红”或“酚酞”)。
⑶实验结论:通过以上实验,说明浓硫酸具有____________________(填写字母代号)。
A.强氧化性 B.脱水性 C.吸水性
⑷问题与计论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是________;他建议在试管B口塞一团棉花,该棉花最好浸泡下列哪种溶液__________(填字母编号);
A.稀盐酸 B.NaOH溶液 C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4g,将试管A中液体稀释成100ml溶液。该溶液中Cu2+物质的量浓度为_____mol·L-1 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是重要的漂白剂。某小组开展如下实验,按如图装置制取无水NaClO2晶体,回答下列问题:
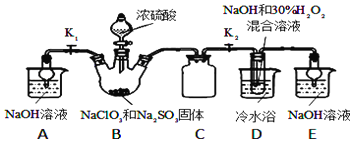
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.
(1)装置C的作用是_________________;
(2)已知装置B中的产物有ClO2气体,则B中反应的方程式为_________________;装置D中反应生成NaClO2的化学方程式为_________________________;
(3)从装置D反应后的溶液中获得无水NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②____________;③用38℃~60℃热水________;④在_____________条件下干燥得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_________和____________;
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+4I-+4H+═2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液.取25.00mL待测溶液,加入淀粉溶液做指示剂,用c molL-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32-═2I-+S4O62-).请计算所称取的样品中NaClO2的物质的量为__________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com