
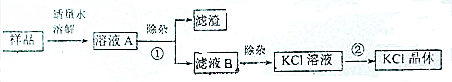
分析 由分离流程可知,固体溶解后,除杂,选择氯化钡、碳酸钾、KOH,使硫酸镁转化为沉淀,溶液B中主要含KCl、KOH、然后加盐酸除杂,最后蒸发结晶得到KCl.
(1)MgSO4与KOH反应生成氢氧化镁和硫酸钾,K2CO3与盐酸反应生成氯化钾、水、二氧化碳;
(2)除杂使镁离子、硫酸根离子及过量试剂转化为沉淀;
(3)滤渣为沉淀物,滤液B为KCl、KOH,应除去KOH;
(4)①分离沉淀和溶液,②分离可溶性固体与水.
解答 解:由分离流程可知,固体溶解后,除杂,选择氯化钡、碳酸钾、KOH,使硫酸镁转化为沉淀,溶液B中主要含KCl、KOH、然后加盐酸除杂,最后蒸发结晶得到KCl.
(1)MgSO4与KOH反应生成氢氧化镁和硫酸钾,反应为MgSO4+2KOH=Mg(OH)2↓+K2SO4,K2CO3与盐酸反应生成氯化钾、水、二氧化碳,反应为K2CO3+2HCl=2KCl+H2O+CO2↑,故答案为:MgSO4+2KOH=Mg(OH)2↓+K2SO4;K2CO3+2HCl=2KCl+H2O+CO2↑;
(2)由上述分析可知,溶液A的“除杂”环节中,先加入过量的BaCl2溶液,除去硫酸根离子,搅拌后,再加入过量的K2CO3溶液,再经搅拌后,再加入过量的KOH溶液,镁离子转化为沉淀,然后过滤,故答案为:K2CO3;KOH;
(3)由上述分析可知滤渣为BaSO4、Mg(OH)2,滤液B中含KCl、KOH,对滤液B除杂加入的试剂是HCl,故答案为:BaSO4、Mg(OH)2;KCl、KOH;HCl;
(4)由上述分析可知,①为过滤,②为蒸发,故答案为:过滤;蒸发.
点评 本题考查混合物分离提纯,为高频考点,把握流程中的反应、物质的性质、混合物分离提纯为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案科目:高中化学 来源: 题型:解答题
| 实验操作 | 答案 | 实验现象 |
| (1)将浓硫酸滴在小木条上 | A.产生白烟 B.产生蓝色物质 C.溶液呈红色 D.变黑色 | |
| (2)将分别蘸浓氨水和浓盐酸的玻璃棒靠近 | ||
| (3)在盛有KI淀粉溶液的试管中滴加氯水 | ||
| (4)在盛有FeC13溶液的试管中滴入2滴KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③①②④ | C. | ④②①③ | D. | ②③①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的实验式就是其分子式 | |
| B. | 质谱法可以测定物质的相对分子量 | |
| C. | 从物质的红外光谱图可以获得分子中含有化学键或官能团的信息 | |
| D. | 从核磁共振氢谱图可以推知该有机物分子有几种不同类型的氢原子及他们的数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电解饱和食盐水制取氯气和烧碱(氯碱工业)
电解饱和食盐水制取氯气和烧碱(氯碱工业)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀时的pH | 2.2 | 7.6 | 4.7 |
| 完全沉淀时的pH | 3.2 | 9.6 | 6.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com