
【题目】(1)工业制硝酸的主要反应为4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH;在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) ΔH;在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
浓度 时间 | c(NH3) (mol/L) | c(O2) (mol/L) | c(NO) (mol/L) |
起始 | 0.8 | 1.6 | 0 |
第2 min | 0.6 | a | 0.2 |
第4 min | 0.3 | 0.975 | 0.5 |
第6 min | 0.3 | 0.975 | 0.5 |
第8 min | 0.7 | 1.475 | 0.1 |
①反应在第2 min到第4 min时,O2的平均反应速率为________。
②反应在第6 min时改变了条件,改变的条件可能是________(填序号)。
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)达到平衡状态的是________(填序号)。
4NO(g)+6H2O(g)达到平衡状态的是________(填序号)。
A.单位时间内生成n mol NO的同时,反应n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6
E.恒压条件下,混合气体的密度不再变化
(2)2A ![]() B+C在某一温度达到平衡,若A是气态,加压平衡不移动,则B为______态。
B+C在某一温度达到平衡,若A是气态,加压平衡不移动,则B为______态。
(3)已知在一定温度下,C(s)+CO2(g) ![]() 2CO(g)平衡常数K;K的表达式__________;C(s)+H2O(g)CO(g)+H2(g)平衡常数K1;CO(g)+H2O(g)
2CO(g)平衡常数K;K的表达式__________;C(s)+H2O(g)CO(g)+H2(g)平衡常数K1;CO(g)+H2O(g)![]() H2(g)+CO2(g)平衡常数K2;则K、K1、K2之间的关系是:K=_____________;
H2(g)+CO2(g)平衡常数K2;则K、K1、K2之间的关系是:K=_____________;
(4)如图1所示,在甲、乙两容器中都充入1mol C和1mol CO2,并使甲、乙两容器初始容积相等.在相同温度下发生反应C(s)+CO2(g)![]() 2CO(g),并维持反应过程中温度不变.已知甲容器中CO2的转化率随时间变化的图象如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图象________.
2CO(g),并维持反应过程中温度不变.已知甲容器中CO2的转化率随时间变化的图象如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图象________.


【答案】0.1875molL-1min-1BBE气K=C(CO2)2/C(CO)K = K1/K2 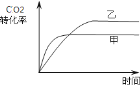
【解析】
(1)①氨气的平均化学反应速率为v=![]() =
=![]() =0.015 mol·L-1·min-1,同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,所以氧气的平均化学反应速率为0.1875mol·L-1·min-1;
=0.015 mol·L-1·min-1,同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,所以氧气的平均化学反应速率为0.1875mol·L-1·min-1;
②通过图表比较起始到第6min和第6min到第8min时知,反应物浓度变大和生成物浓度变小,逆向移动,所以改变的条件是升高温度;选项B正确,使用催化剂,平衡不移动,选项A错误;减小压强和增加O2的浓度,正向移动,选项C、D错误;故答案选B;
③A.单位时间内生成n mol NO的向时,生成n mol NH3,说明v正=v逆,选项A正确;B.条件一定,混合气体的平均相对分子质量不再变化,方程式两边气体的化学计量数之和不相等,气体的物质的量是个变化的量,气体的质量始终不变,所以混合气体的平均相对分子质量不变,证明正逆反应速率相等,达到了平衡状态,选项B正确;C.百分含量w(NH3)=w(NO),不能说明v正=v逆,选项C错误;D.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6,不能说明v正=v逆,选项D错误;E.由于反应方程式两边气体的质量不变,容器的容积不变,所以混合气体的密度可变,因此混合气体的密度是一个变量,可以判断是否达到了平衡状态,选项E正确;答案选BE;
(2)增大化学平衡不移动,反应前后气体的物质的量相等,A是气态时,则B为气态,C为气态;
(3)已知在一定温度下,C(s)+CO2(g) ![]() 2CO(g);K的表达式为K=
2CO(g);K的表达式为K=![]() ;
;
C(s)+H2O(g)![]() CO(g)+H2(g)平衡常数K1=
CO(g)+H2(g)平衡常数K1=![]() ;
;
CO(g)+H2O(g)![]() H2(g)+CO2(g)平衡常数K2=
H2(g)+CO2(g)平衡常数K2=![]() ;
;
K=![]() =
=![]() ;
;
(4)C(s)+CO2(g) ![]() 2CO(g),随着反应的进行,甲中压强逐增大,而乙是恒压,故乙相对于甲而言,相当于减小压强,平衡正向移动,化学反应速率减慢,二氧化碳的转化率增大,故乙容器中CO2的转化率随时间变化的图象为:
2CO(g),随着反应的进行,甲中压强逐增大,而乙是恒压,故乙相对于甲而言,相当于减小压强,平衡正向移动,化学反应速率减慢,二氧化碳的转化率增大,故乙容器中CO2的转化率随时间变化的图象为: 。
。


科目:高中化学 来源: 题型:
【题目】从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。 以下是氯元素形成物质的二维图的部分信息。

(1)根据图中信息,写出任意两种氯的含氧酸的化学式_____、_____。
(2)写出 NaOH 溶液吸收 Cl2 的离子方程式_____。
(3)实验室常用高锰酸钾固体与浓盐酸在常温下反应来快速制备少量氯气。反应方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①浓盐酸在上述反应中显示_____(填写序号)。
A 只有还原性 B 只有氧化性
C 既有氧化性又有酸性 D 既有还原性又有酸性
②当反应过程中有 6.02×1022 个电子发生转移时,生成 Cl2 的体积为_____(在标 准状况下),被氧化的 HCl 的物质的量为_____。
(4)潮湿的 Cl2 与 Na2CO3 混合制取少量 Cl2O 的反应中,Cl2既体现了氧化性,也体现了还原性,且生成2种盐。写出反应的化学方程式,并用双线桥标出电子转移的方向和数目_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列分类依据和结论都正确的是
A.明矾、芒硝都是盐,都属于纯净物
B.HNO3、C2H5OH都易溶于水,都是电解质
C.苏打、氢氧化钠溶液均显碱性,都是碱
D.H2SO4、H2SiO3分子中均含有两个氢原子,都是二元强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生如下反应mA(g) + nB(g)![]() pC(g) + qD(s),达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍,下列说法正确的是
pC(g) + qD(s),达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍,下列说法正确的是
A. m+n < p+q B. 平衡向逆反应方向移动
C. A的转化率提高 D. C的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞的元素和化合物的说法,正确的是
A. Mg是微量元素,是叶绿素的组成成分 B. 土壤和植物根细胞内的元素种类、含量相同
C. 微量元素在细胞中含量很少,可有可无 D. 组成细胞的元素中,C、H、O、N的含量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A(g)+3B(g) =2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
A. v(A)=0.01 mol/(Ls) B. v(B)=0.02 mol/(Ls)
C. v(B)=0.60mol/(Lmin) D. v(C)=1.0mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】15N﹣NMR(核磁共振)可用于测定蛋白质、核酸等生物大分子的空间结构,KurtWuthrich等人为此获得诺贝尔化学奖。下面有关15N叙述不正确的是( )
A.质量数为15B.核内质子数为7
C.核内中子数为8D.核外电子数为15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据A~E几种烃分子的示意图填空。

(1)A分子的空间构型为___________。
(2)B的名称是___________。
(3)D的分子式是___________。
(4)C、E的关系是___________(填“同系物”或“同分异构体”或“同一种物质”)。
(5)A~E表示的物质中,能发生加成反应的两种物质是___________(填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com