
分析 (1)①根据c=$\frac{1000ρw}{M}$进行计算求解;
②根据反应方程式计算;
(2)根据化合价升降总数相等来计算NaBrO3的物质的量.
解答 解:(1)①c=$\frac{1000ρw}{M}$=$\frac{1000×1.1×0.1}{106}$=1.04mol/L,
答:纯碱溶液的物质的量浓度为1.04mol/L;
②设消耗溴的质量为mg,
3Na2CO3+3Br2→5NaBr+NaBrO3+3CO2
480g 67.2L
m 3.36L
m=$\frac{480g×3.36L}{67.2L}$=24g,
答:吸收的Br2为24g;
(2)生成0.1mol NaCl与0.6mol NaBr,化合价降低总数为0.1mol+0.6mol=0.7mol,则化合价升高总数为:0.7mol,生成NaBrO3的物质的量为$\frac{0.7mol}{5}$=0.14mol,答:溶液中NaBrO3的物质的量为0.14mol.
点评 本题考查了物质的量浓度的计算和根据方程式的计算,学生要学会根据反应方程式,列出已知量与未知量之间的关系,难度较大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫可用于杀菌、消毒 | |
| B. | 煤经过气化和液化等物理变化可转化为清洁能源 | |
| C. | 氯气和明矾均可做自来水的消毒剂 | |
| D. | 食品保鲜剂中所含铁粉和生石灰均作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾作净水剂 | |
| B. | 黄河入海口处容易形成沙洲 | |
| C. | 可用半透膜除去淀粉溶液中的少量NaCl | |
| D. | 将植物油倒入水中用力搅拌可形成油水混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ①④ | C. | ②③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2C=CH-CH=CH2 1,3-二丁烯 | B. |  :间二甲苯 :间二甲苯 | ||
| C. |  2,6-二甲基-5-乙基庚烷 2,6-二甲基-5-乙基庚烷 | D. | 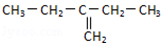 2-乙基-1-丁烯 2-乙基-1-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:
在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2mol H2、1mol CO | 1mol CH3OH | 4mol H2、2mol CO |
| 平衡时n(CH3OH) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1KJ | 吸收Q2KJ | 放出Q3KJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com