
| A. | 3,3-二甲基丁烷 | B. | 3-甲基-1-戊烯 | ||
| C. | 2,2-二甲基-1-戊烯 | D. | 3-甲基-2-乙基戊烷 |
分析 按照名称写出结构,再根据烷烃和烯烃的命名原则进行命名,据此进行判断.
A、碳链编号不正确.
B、符合烷烃命名原则.
C、此物质不存在;
D、主链选择不正确.
解答 解:A、对主链上的碳原子编号时,应从离支链近的一端开始编,故正确的名称为:2,2-二甲基丁烷,故A错误;
B、烯烃命名时,应选择含官能团的最长碳链为主链,从离官能团近的一端开始编号,故此化合物的命名正确,故B正确;
C、当双键处于1号和2号碳原子之间时,2号碳上不可能连接2个甲基,故此物质不存在,故C错误;
D、烷烃命名时,应选择最长的碳链为主链,故此物质的正确名称为3,4-二甲基己烷,故D错误.
故选B.
点评 考查烷烃的命名,难度不大,烷烃命名要抓住五个“最”:①最长-----选最长碳链为主链;②最多-----遇等长碳链时,支链最多为主链;③最近-----离支链最近一端编号;④最小-----支链编号之和最小(两端等距又同基,支链编号之和最小);⑤最简-----两不同取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下28g氮气含有的原子数是2NA | |
| B. | 标准状况下,22.4L醋酸的水分子数是NA | |
| C. | 1molCl2与足量Fe反应,转移的电子数为2NA | |
| D. | 500mL 2mol•L-1Al(SO4)3溶液中SO42-的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可使石蕊试液褪色 | B. | 与足量的NaOH溶液反应生成Na2SO4 | ||
| C. | 不能与过氧化氢(H2O2)溶液反应 | D. | 能使品红褪色,加热后又出现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一个多电子原子中,不可能有两个运动状态完全相同的电子 | |
| B. | 在一个多电子原子中,不可能有两个能量相同的电子 | |
| C. | 在一个多电子原子中,N层上的电子能量肯定比M层上的电子能量高 | |
| D. | 某个多电子原子的3p能级上仅有两个电子,它们的自旋状态必然相反 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| O-O键 数据 | O22- | O2- | O2 | O2+ |
| 键长(10-12 m) | 149 | 128 | 121 | 112 |
| 键能(kJ•mol-1) | x | y | z=494 | w=628 |
| A. | 成键的电子数越多,键能越大 | B. | 键长越长,键能越小 | ||
| C. | 成键所用的电子数越少,键能越大 | D. | 成键时电子对越偏移,键能越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 气体 | CO | N2 | CO2 | H2 | O2 |
| 体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
| 化学式 | H2CO3 | HClO | H2C4H4O6(酒石酸) |
| 电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和反应反应热的测定实验中,将环形玻璃搅拌棒换成环形铜丝搅拌棒测定出来的中和热值偏大 | |
| B. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6KJ/mol | |
| C. | 将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6KJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3KJ/mol,则H2SO4和Ca(OH)2反应的反应热△H=-(2×57.3)KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
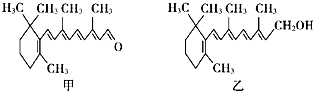
| A. | 视黄醛的分子式为C21H26O | |
| B. | 维生素A分子结构中含有苯环、碳碳双键和羟基 | |
| C. | 视黄醛是维生素A的氧化产物 | |
| D. | 1 mol甲和1 mol乙在一定条件下均最多能与6 mol H2发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com