
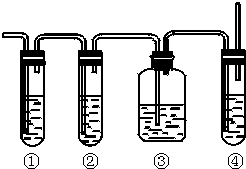
分析 二氧化硫的检验用品红溶液,乙烯的检验用高锰酸钾酸性溶液,乙烯和二氧化硫都能使高锰酸钾酸性溶液褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯,然后回答问题.
解答 解:二氧化硫的检验用品红溶液,乙烯的检验用高锰酸钾酸性溶液,乙烯和二氧化硫都能使高锰酸钾酸性溶液褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯.
(1)因装置①用来检验SO2,试管中品红溶液褪色,说明含有SO2,装置②试管装有NaOH溶液除去SO2,装置③试管通过品红溶液不褪色确认SO2已除干净,装置④通过高锰酸钾酸性溶液褪色检验乙烯,
故答案为:①A;②B;③A;④D;
(2)装置①用来检验SO2,试管中品红溶液褪色,说明含有SO2,
故答案为:品红溶液褪色;
(3)装置②试管装有NaOH溶液除去SO2,
故答案为:除去SO2,以免干扰乙烯的检验;
(4)装置③试管通过品红溶液不褪色确认SO2已除干净,
故答案为:确认SO2已除干净;
(5)装置③试管通过品红溶液不褪色,装置④通过高锰酸钾酸性溶液褪色检验乙烯,
故答案为:装置③中品红溶液不褪色,装置④高锰酸钾酸性溶液褪色.
点评 本题主要考查了实验室制乙烯产物的检验,当有多种产物需检验时,应考虑先后顺序,在除去杂质气体时不能引入新杂质,题目难度不大.


科目:高中化学 来源: 题型:解答题
 如图是周期表中原子序数小于20的9种元素单质的沸点与原子序数的关系,图中原子序数是连续的.试根据如图,回答下列问题:
如图是周期表中原子序数小于20的9种元素单质的沸点与原子序数的关系,图中原子序数是连续的.试根据如图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 0.1032mol/LHCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 25.53 | 25.00 |
| 3 | 27.85 | 25.00 |
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | SiCl4 | SiHCl3 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 33.0 | - | 315 |
| 升华温度/℃ | - | - | 180 | 300 |
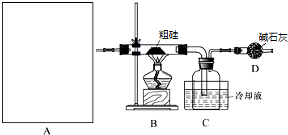
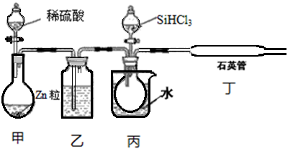
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
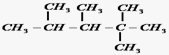
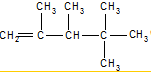 、
、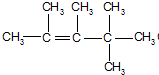 、
、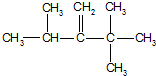 .
.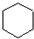 ,E是CH3CH3.
,E是CH3CH3. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
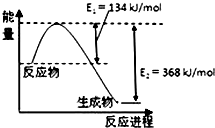
| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 等量H2在O2中完全燃烧,生成H2O(g)与生成H2O(1)放出的能量相同 | |
| C. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | |
| D. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com