
| A. | 正反应速率增大,逆反应速率减小 | B. | X的转化率变大 | ||
| C. | Y的转化率变大 | D. | 新平衡时X的体积分数减小 |
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①②④ | C. | ①②④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
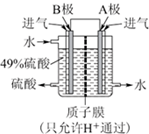 利用原电池原理合成硫酸成为可能,如图利用SO2和O2制备硫酸.其中A、B为多孔材料,可吸附气体.回答下列问题.
利用原电池原理合成硫酸成为可能,如图利用SO2和O2制备硫酸.其中A、B为多孔材料,可吸附气体.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NaHCO3溶液中离子浓度关系:C(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 0.1mol/L NH4Cl和0.1mol/L NH3•H2O等体积混合后离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-) | |
| D. | 常温下,在pH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 L水中溶解了58.5g NaCl,该溶液的物质的量浓度为1mol•L-1 | |
| B. | 从1 L 2mol•L-1的H2SO4溶液中取出0.5L,剩余溶液的浓度仍为2mol•L-1 | |
| C. | 制成0.5L 10mol•L-1的盐酸,需标准状况下氯化氢气体112L | |
| D. | 中和100mL 1mol•L-1的H2SO4溶液,需NaOH的质量为4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 咖啡酸(见图),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.
咖啡酸(见图),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好. .
. ,咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为
,咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为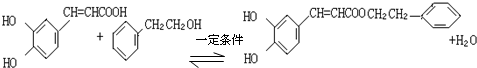 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸 | B. | Ba(OH)2稀溶液 | C. | MgCl2溶液 | D. | CuSO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com