
| A. | 充电时,阳极附近溶液的pH增大 | |
| B. | 充电时,阴极的电极反应式为pb2++2e-═pb | |
| C. | 放电时,转移1mol电子时负极减少的质量为103.5g | |
| D. | 放电时,正极的电极反应式为PbO2+2e-+4H+═pb2++2H2O |
分析 原电池的总反应为:Pb+PbO2+4HBF4$?_{充电}^{放电}$2Pb(BF4)2+2H2O,故放电时负极反应为:Pb-2e-=Pb2+;正极反应:PbO2+2e-+4H+=Pb2++2H2O,阴离子移向负极,阳离子移向正极;
充电时,阴极反应:Pb2++2e-=Pb,阳极反应:Pb2++2H2O-2e-=PbO2+4H+,阴离子移向阳极,阳离子移向阴极.据此分析.
解答 解:A.充电时,阳极反应:Pb2++2H2O-2e-=PbO2+4H+,产生大量氢离子,故阳极附近溶液的酸性增强,故A错误;
B.充电时阴极发生还原反应,为Pb2++2e-=Pb,故B正确;
C.放电时负极反应为:Pb-2e-=Pb2+,转移1mol电子时负极减少的质量为207g/mol×0.5mol=103.5g,故C正确;
D.由总反应可知放电时,正极发生还原反应,电极反应式为PbO2+2e-+4H+═pb2++2H2O,故D正确.
故选A.
点评 本题考查了原电池中电极反应式的书写和离子移动方向的判断,为高频考点,应注意的是在原电池中,阴离子移向负极,阳离子移向正极;在电解池中,阴离子移向阳极,阳离子移向阴极.


科目:高中化学 来源: 题型:解答题
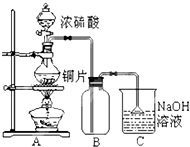 某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)| 序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
| 方案① | 高锰酸钾溶液中含有硫酸,与氯化钡反应,使生成的沉淀增多 | 偏低 | 将硫酸酸化的高锰酸钾溶液换成溴水或碘水或硝酸溶液 |
| 方案② | 不填 | 不填 | 不填 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol MgCl2中含有的离子数为3NA | |
| B. | 标况下3.36LCCl4中所含碳原子数约为0.15×6.02×1023 | |
| C. | 标准状况下,22.4L氦气与22.4L氯气所含原子数均为2NA | |
| D. | 标准状况下,1molCl2在反应中一定得到2NA电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 | |
| C. | 有单质参加或生成的反应不一定属于氧化还原反应 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下Cu与浓硫酸不反应,是因为发生了钝化 | |
| B. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| C. | FeCl2、NaHSO3、Fe(OH)3均能通过化合反应直接制得 | |
| D. | NH4HCO3、NH4Cl、I2受热后均无固体剩余 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
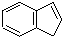 .下列关于茚的说法中不正确的是( )
.下列关于茚的说法中不正确的是( )| A. | 茚能使酸性高锰酸钾溶液褪色 | |
| B. | 茚能使溴的四氯化碳溶液褪色 | |
| C. | 1 mol茚只含有1 mol碳碳双键 | |
| D. | 茚中所有的原子均可能处在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com